
| A. | 该溶液中c(SO42-)=0.2mol/L | |
| B. | 该溶液中c(SO42-)=2c(Al3+) | |
| C. | 该溶液中:3c(Al3+)+c(K+)+c(H+)=2c(SO42-) | |
| D. | 向该溶液中加入2L0.1mol/LBa(OH)2溶液,生成的沉淀为BaSO4 |
分析 47.4g明矾[KAl(SO4)2•12H2O]的物质的量为:$\frac{47.4g}{474g/mol}$=0.1mol,
A、0.1molKAl(SO4)2•12H2O溶液中硫酸根离子的物质的量为0.2mol;
B、铝离子部分水解;
C、根据电荷守恒分析解答;
D、2L0.1mol/LBa(OH)2溶液的物质的量为0.2mol,所以钡离子的物质的量为0.2mol、氢氧根离子的物质的量为0.4mol,结合0.1mol的明矾分析解答;
解答 解:A、0.1molKAl(SO4)2•12H2O溶液中硫酸根离子的物质的量为0.2mol,溶剂水的体积是1L,而溶液的体积不知,所以无法求物质的量浓度,故A错误;
B、铝离子部分水解,所以c(SO42-)>2c(Al3+),故B错误;
C、根据电荷守恒,该溶液中:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),故C错误;
D、2L0.1mol/LBa(OH)2溶液的物质的量为0.2mol,所以钡离子的物质的量为0.2mol、氢氧根离子的物质的量为0.4mol,0.1mol的明矾电离产生0.1mol的铝离子和0.2mol的硫酸根离子,0.1mol的铝离子与0.4mol的氢氧根离子恰好完全反应生成0.1mol的偏铝酸根离子,而0.2mol的钡离子与0.2mol的硫酸根离子恰好反应生成0.2mol的硫酸钡沉淀,所以生成的沉淀为BaSO4,故D正确;
故选D.
点评 本题物质的量浓度的相关计算,涉及物质的量浓度的计算、盐的水解、电荷守恒和离子反应,综合性强,有关计算培养学生分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 用带玻璃瓶塞的试剂瓶盛放NaOH溶液 | |
| B. | 硅是地壳中含量最多的元素 | |
| C. | SiO2不溶于水,也不溶于任何酸 | |
| D. | 晶体硅是良好的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
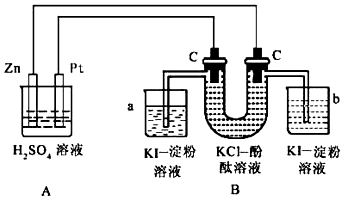
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
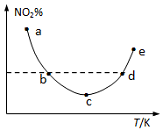 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g).反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g).反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.据图分析,下列说法正确的是( )| A. | 图中a、b两点对应的反应未达到平衡状态 | |
| B. | 图中b、d两点对应的NO2速率相等 | |
| C. | 该反应为吸热反应 | |
| D. | e点对应的容器中气体颜色最深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Co元素的化合价升高 | |
| B. | 放电时,正极的电极反应式为Lil-xCoO2+xe-+xLi+=LiCoO2 | |
| C. | 充电时,Li+在电解质中由阳极向阴极迁移 | |
| D. | 充电时,阴极的电极反应式为C6+xLi++xe-=LixC6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | pH相同的HX、HY溶液,HY的物质的量浓度小 | |
| B. | 相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| C. | 结合H+的能力:Y->CO32->X->HCO3- | |
| D. | 向NaX溶液中通入CO2的化学方程式:2NaX+CO2+H2O=Na2CO3+2HX |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在,Na+可能存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com