
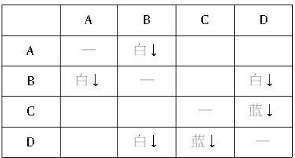


科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| O | 2-3 |
| O | 2-4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+既能与硫氰化钾反应生成血红色的配合物,又能与K4[Fe(CN)6]反应生成蓝色溶液 |
| B.用邻苯二甲酸氢钠滴定氢氧化钠时应采用甲基橙为指示剂 |
| C.利用KMnO4酸性溶液可推算出室内空气中甲醛的浓度 |
| D.溶液酸碱性对H2O2的稳定性有较大影响,在酸性溶液中,H2O2分解较快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入硝酸酸化,再滴加KSCN溶液后有血红色物质生成,则原溶液中一定有Fe3+存在 |
| B.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32-存在 |
| C.用某溶液做焰色反应实验时火焰为黄色,则该溶液中一定有钠元素,可能有钾元素 |
| D.分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐溶液,只用NaOH溶液是不能一次鉴别开的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32- NO3- SO42- I- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.要证明某溶液中不含Fe3+而可能含Fe2+,先加氯水,再加少量的KSCN溶液 |
| B.为防止FeSO4被氧化而变质,常在溶液中加入少量的铁粉 |
| C.将Fe(OH)2露置在空气中加热灼烧可以得到FeO |
| D.向AlCl3溶液中加入过量氨水,过滤,沉淀灼烧可得到Al2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com