
【题目】已知反应:N2(g)+O2(g)![]() 2NO(g),△H=+180.50 kJ·mol-1;△S=247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
2NO(g),△H=+180.50 kJ·mol-1;△S=247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
A. 能使该反应物中活化分子数和活化分子百分数同时增大的方法只能是使用催化剂
B. 到达平衡状态时,v(N2)=2v(NO)
C. 在1000℃时,此反应能自发进行
D. 一定温度下,该反应达到平衡状态后,增加N2的浓度,化学反应平衡常数变大
科目:高中化学 来源: 题型:
【题目】中科大陈乾旺教授等人发明![]() 合成金刚石的新方法,化学原理为:①
合成金刚石的新方法,化学原理为:①![]() (未配平)该方法比1955年人工首次制得金刚石的旧方法容易得多。②
(未配平)该方法比1955年人工首次制得金刚石的旧方法容易得多。②![]() 。以下表述正确的是( )
。以下表述正确的是( )
A. 反应①中既有旧化学键的断裂又有新化学键的形成
B. 新方法利用的是物理变化,旧方法利用的是化学变化
C. 在反应①中每生成![]() 金刚石需要消耗
金刚石需要消耗![]() 金属钠
金属钠
D. 反应①和反应②中所得的金刚石都是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组在实验室利用直接合成法制各甘氨酸亚铁。有关物质性质如下所示:
甘氨酸( NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇、 | 易溶于水和乙醇, | 易溶于水, |
两性化合物 | 有强酸性和还原性 | 难溶于乙醇 |
实验过程及装置图如下(夹持和加热仪器已省略):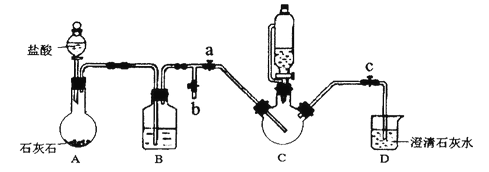
I.合成:在C中加入0.10mol甘氨酸、0.05mol硫酸亚铁、少量柠檬酸和200mL水,利用CO2将C装置中的空气排净,然后在40℃恒温条件下用磁力搅拌器不断搅拌,并用恒压滴液漏斗向C中滴加6mol·L-1NaOH溶液调节pH到6左右,使反应物充分反应。
II.分离:加入无水乙醇,立即出现白色沉淀。将沉淀进行过滤、洗涤,收集滤渣。
Ⅲ.提纯:将滤渣溶解于适量的蒸馏水中,然后结晶、过滤,将纯化后的产品放入真空干燥箱中干燥后称重。
回答下列问题:
(1)B装置的作用是______________;
(2)能证明C装置中空气排净的现象是______________;向C中滴加NaOH溶液之前应该停止滴加盐酸,且关闭止水夹____________,打开止水夹________
(3)“合成”中加入柠檬酸的作用是______________:请写出合成甘氨酸亚铁的化学方程式_________。
(4)加入乙醇的目的是________;“提纯”时用的结晶方法为________________
(5)通过测量得知:等浓度(NH2CH2COO)2Fe 溶液导电能力远小于FeSO4溶液。暴露在空气中,(NH2CH2COO)2Fe溶液比FeSO4溶液难被氧化,请分析原因为________
(6)若产品质量为ag,则产率为________ %。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥法标出下列反应中电子转移的方向和数目:_____________。
MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
此反应中,还原剂是 _______,氧化剂是 ________;_____元素被氧化,__元素被还原。由此可知,氧化还原反应的实质是__________________________________________。根据你的理解再写一个常见的氧化还原反应的化学方程式: _______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苄丙酮香豆素(H)常用于防治血觑栓栓塞性疾病。其合成路线如图所示(部分反应条件略去。)
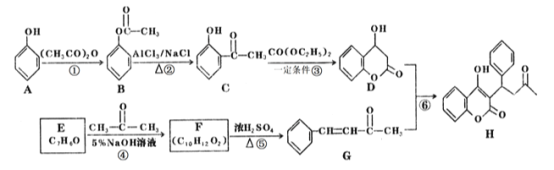
(1)E的名称是_________,D中含氧官能团的名称是_________。
(2)反应①的反应类型是__________,反应⑤的反应类型是_________。
(3)1mol H与H2加成,最多可消耗_____mol H2。
(4)反应③的化学方程式为____________________________________。
(5)C的同分异构体中满足下列条件的有______种,其中核磁共振氢谱有4组峰且峰面积之比为1:2:2:3的结构简式为__________(写一种即可)。
①不能和FeCl3溶液发生显色反应 ②1mol该有机物能与2molNaOH恰好完全反应
(6)参照苄丙酮香豆素的合成路线,设计一种以E和乙醛为原料制备![]() 的合成路线________。
的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)![]() 3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.在共价化合物中一定含有共价键
B.含有共价键的化合物一定是共价化合物
C.含有离子键的化合物一定是离子化合物
D.全部由非金属组成的化合物可能是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 常温常压下,20g氖气所含有的原子数目为0.5NA
B. 2.8铁粉与50mL4 mol·L-1盐酸完全反应转移电子的数目为0.1NA
C. 标准状况下,22.4 LSO2和SO3混合物中含有的硫原子数目为0.1NA
D. 28g的C2H4和N2混合气体中含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验,能达到实验目的的是
实验装置 |
|
|
|
|
实验目的 | 实验验证浓硫酸具有脱水性、氧化性 | 制取并收集少量氨气 | 验证NaHCO3和Na2CO3的热稳定性 | 采用CCl4萃取I2 |
A | B | C | D |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com