
Na2SO3是一种重要化工原料。
(1)向1.0 moL/L的Na2SO4溶液中滴加酚酞,溶液变为红色。用离子方程式解释其原因________________________。
(2)工业上Na2SO3可用于吸收烟气中的SO2。将烟气通入1L 1.0 mol/L的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO4的能力显著下降,应对吸收剂进行处理。
①当该吸收剂吸收了8.96 L SO2(换算成标准状况),此时溶液中c(CO32-):c(HSO3-)=_________。
②下图为不同脱硫剂和不同浓度的Na2SO3对脱硫效率的影响。

下列说法中,正确的是 。
a. Na2SO3浓度越高脱硫效率越高
b. 相同条件下,四种脱硫剂中NaOH的脱硫效率最高
c. 对于相同浓度的Na2SO3溶液,温度越高脱硫效率越高
d. 当溶液pH约为6时,此时所得溶液的溶质只有NaHSO2
③溶液吸收能力下降后,进行加热再生,同时得到浓的SO2。加热再生的化学方程式是____________________。
科目:高中化学 来源: 题型:
下列判断正确的是 ( )
①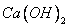 微溶于水,所以
微溶于水,所以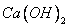 是弱电解质;
是弱电解质;
②强电解质溶液的导电能力可能比弱电解质溶液导电能力弱;
③液态氯化氢不导电,但它是电解质;
④碳酸氢钠是弱酸的酸式盐,所以是弱电解质;
⑤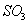 溶于水后导电,所以
溶于水后导电,所以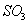 是电解质;
是电解质;
⑥Cu能导电,但它不是化合物,所以Cu是非电解质
A、②③
B、②③⑥
C、①④⑤⑥
D、②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物Ⅳ为一种重要的化工中间体,其合成方法如图K293所示:
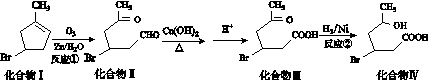
图K293
(1)化合物Ⅰ的化学式为________;化合物Ⅳ除了含有-Br 外,还含有的官能团是________。
(2)化合物Ⅱ具有卤代烃的性质,在一定条件下能形成双键,该反应条件是________________________。
(3)1 mol化合物Ⅲ与足量NaOH溶液反应,消耗NaOH的物质的量为________mol。
(4)化合物Ⅳ能发生酯化反应生成六元环化合物Ⅴ,写出该反应的化学方程式:________________________________________________________________________。
(5)根据题给化合物的转化关系及相关条件,请你推出CH2CCHCH2CH3(2甲基1,3丁二烯)发生类似①的反应,得到有机物Ⅵ和Ⅶ,结构简式分别是________、________,它们的物质的量之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常见的无机酸25℃时在水溶液中的电离常数如下表(电离常数即电离平衡的平衡常数,与化学平衡类似。其中K1表示第一步电离的电离常数;K2表示第二步电离的电离常数):
| 无机酸 | 氢氰酸(HCN) | 碳酸(H2CO3) | 氢氟酸(HF) |
| 电离平衡常数K值 | 6.2×10-10(K) | 4.2×10-7(K1) 5.6×10-11(K2) | 6.61×10-4(K) |
下列选项正确的是
A. 氟化钠溶液中通入过量CO2:F-+H2O+CO2=HF+HCO3-
B. Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C. 中和等体积、等pH的氢氰酸(HCN)和氢氟酸(HF)消耗NaOH的量前者大于后者
D. 等浓度的NaCN和NaF溶液中pH前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一部分氧化的Na2SO3样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
A. 将样品配制成溶液V1L,取其中25.00 mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液V2 mL
B. 向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为b g
C. 将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g
D. 将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重d g
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是制取和收集气体的实验装置,该装置可用于( )
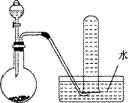
A、用浓盐酸跟二氧化锰反应制取Cl2
B、用浓氨水和生石灰反应制取NH3
C、用电石跟水反应制取C2H2
D、用浓硝酸跟铜反应制取NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知气体的摩尔质量越小,扩散速度越快。如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于甲、乙的判断正确的是( )
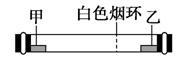
A、甲是浓氨水,乙是浓硫酸
B、甲是浓盐酸,乙是浓氨水
C、甲是浓氨水,乙是浓盐酸
D、甲是浓硝酸,乙是浓氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al B.Al(OH)3
C.AlCl3 D.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)= ;
若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)= 。
(2)在CH3COONa的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)明矾的水溶液显酸性,其原因是(用离子方程式表示) 。
(4)在25℃、101kPa下,0.5mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 。
(5)1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为 。
(6)已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol ;
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4与NO2与完全反应生成氮气和气态水的热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com