
【题目】在2L恒容密闭容器中,某可逆反应(ABC均为气体)进行过程中, 在不同反应时间各物质物质的量的变化情况如图所示。则该反应的化学方程式为_________________;开始至2分钟时,用C表示其反应速率为__________。
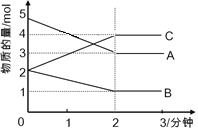
【答案】2A+B![]() 2C 0.5molL-1 min-1
2C 0.5molL-1 min-1
【解析】
图中横坐标是时间,纵坐标是物质的量,反应进行到两分钟时达到平衡。根据图中达到平衡时各物质的变化量的关系便可写出化学方程式;用C物质的量的变化量除以体积,再除以所用时间便可得用C表示的化学反应速率。
从图中可知,A减少的物质的量是:5mol-3mol=2mol,B减少的物质的量是:2mol-1mol=1mol,C增加的物质的量是:4mol-2mol=2mol,所以各物质的计量数关系是:A:B:C=2:1:2,同时考虑该反应是可逆反应,化学方程式应写成:2A+B![]() 2C;v(C)=2mol÷2L÷2min=0.5molL-1 min-1。答案为:2A+B
2C;v(C)=2mol÷2L÷2min=0.5molL-1 min-1。答案为:2A+B![]() 2C;0.5molL-1 min-1
2C;0.5molL-1 min-1


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸![]() 是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用
是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用![]() 和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
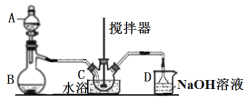
(1)仪器B的名称____________。
(2)B中产生SO2,其化学方程式为_______________________________________。
(3)三颈烧瓶C中浓硝酸与![]() 在浓硫酸作用下反应制得
在浓硫酸作用下反应制得![]()
①实验前浓硝酸和浓硫酸混合的操作为______________________________________。
②C中反应温度不能太高的原因为___________________________________。
③用冷水浴维持C温度不变,开始反应较慢,待生成少量![]() 后,反应明显加快,其原因可能是______________________。
后,反应明显加快,其原因可能是______________________。
(4)测定产品的纯度
准确称取1.5g产品放入锥形瓶中,加入![]() 、100.00mL的
、100.00mL的![]() 溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
已知:![]()
①草酸钠与高锰酸钾溶液反应的离子方程式为__________________________________。
②滴定终点的现象为______________________________________________。
③亚硝酰硫酸的纯度![]() ________。[保留三位有效数字,M(NOSO4H)=127g/mol]
________。[保留三位有效数字,M(NOSO4H)=127g/mol]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在高温、高压、催化剂作用下,1 mol 金刚石转化为石墨,放出 1.9 kJ 的热量。
(1)石墨和金刚石中,_____能量高,_____更稳定。
(2)推测石墨与金刚石各 1 mol 在相同条件下燃烧,_____放出的热量多。
(3)反应符合图示的是______________
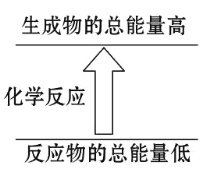
A.铝片与盐酸的反应
B.消石灰与 NH4Cl 晶体的反应
C.酸碱中和反应
D.甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
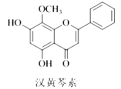
A.该物质遇FeCl3溶液不显色
B.汉黄芩素的分子式为C16H12O5
C.1 mol该物质与溴水反应,最多消耗1 mol Br2
D.与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】央视报道《王者归“铼”》:中国发现超级金属“铼”,飞机火箭上天全靠它,有望打破美国垄断。
(1)铼(Re)被称为类锰元素,与锰的外围电子结构数相同,已知Mn的外围电子排布式为3d54s2,写出75Re的外围电子排布式:______,其最高价氧化物的化学式为_______。
(2)铢合金可作为醇脱氢反应的催化剂:CH3OH![]() HCHO+H2↑,上述反应两种有机物中碳原子的杂化形式分别是______和_______。C、H、O三种元素中,电负性最大的是______(填元素符号)。
HCHO+H2↑,上述反应两种有机物中碳原子的杂化形式分别是______和_______。C、H、O三种元素中,电负性最大的是______(填元素符号)。
(3)实验中常用过硫酸盐氧化法测定钢铁中锰的含量,反应原理为2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+。已知H2S2O8的结构简式如图所示。
2MnO4-+10SO42-+16H+。已知H2S2O8的结构简式如图所示。
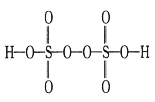
上述反应中S2O82-断裂的共价键类型为___(填“σ键”或“π键”),每生成0.3molMnO4-,过硫酸根中断裂的共价键数目为_____NA。
(4)科学家研制出一种新型的超硬材料,类似于金刚石的结构,但硬度比金刚石大,该晶体元素组成为C和N,其晶胞如图所示(图示原子都包含在晶胞内),则该晶胞所含氮原子的个数为____。已知晶胞参数分别为a nm、b nm、c nm,,该晶体的摩尔质量为Mg·mol-1,密度为ρg·cm-3,则阿伏加德罗常数的数值为___(用含a、b、c、ρ、M的代数式表示)。
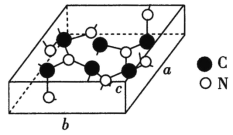
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理某废水时,反应过程中部分离子浓度与反应进程关系如下图,反应过程中主要存在N2、HCO3、ClO、CNO(C+4价,N-3价)、Cl等微粒。下列说法不正确的是

A.该废水呈强酸性
B.废水处理后转化为无害物质
C.反应的离子方程式:3ClO+2CNO+H2O == N2+2HCO3+3Cl
D.每处理1 mol CNO转移3 mol e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素的最高价氧化物对应水化物的化学式分别为![]() 和
和![]() 。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是( )
。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是( )
A.原子半径:![]()
B.氢化物稳定性:![]()
C.原子核内质子数:![]()
D.最高价氧化物对应水化物的碱性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是

A. 该反应的H>0B. C点时达到平衡状态
C. 增加C的量能够增大SO2的转化率D. T3时增大压强,能增大活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究溶液的 pH 对 KI 与 O2 反应的影响,实验如下。
装置 | 烧杯中的液体 | 现象 |
| ① 2 mL 1 mol/L KI 溶液+5 滴淀粉 | 5 分钟后无明显变化 |
② 2 mL 1 mol/L KI 溶液+5 滴淀粉+2 mL 0.2 mol/L HCl 溶液 | 5 分钟后溶液变蓝 | |
③ 2 mL 1 mol/L KI 溶液+5 滴淀粉+2 mL 0.2 mol/L KCl 溶液 | 5 分钟后无明显变化 | |
④ 2 mL pH=8.5 混有 KOH 的 1 mol/L KI 溶液+5 滴淀粉 | 5 小时后溶液才略变蓝 | |
⑤ 2 mL pH=10混有KOH的1 mol/L KI 溶液+5 滴淀粉 | 5 小时后无明显变化 |
(1)实验①中无现象,可能的原因是:i.KI与O2不反应,ii._____。
(2)若放置5小时后,实验①中的溶液变蓝,则反应的离子方程式是_____。
(3)去掉实验③,对该探究过程_____(填“有”或“没有”)影响。
(4)对比实验②和实验④,可以得出的结论是_____。
(5)对于实验⑤的现象,甲同学提出猜想“pH=10时O2不能氧化 I-”,设计了下列装置进行实验⑥,验证猜想。
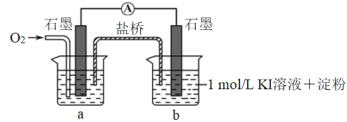
i.烧杯a 中的溶液为_____。
ii. 实验结果是b 中溶液变蓝,此猜想不成立。通入O2后,a中的电极反应式是_____。
iii.实验⑥的结果说明实验⑤中“无明显现象的原因”是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com