
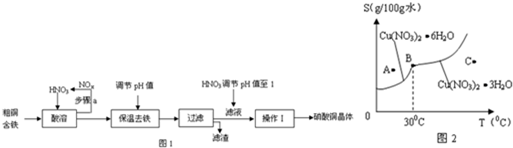
| 氢氧化物开始沉淀时的pH | 氢氧化物开始沉淀时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 |
| 4 |
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
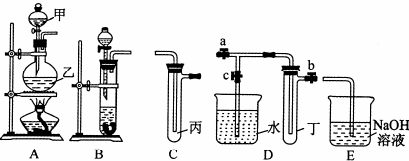
| 序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯水与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯水与水反应的产物有具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、铜
| ||||
B、铜
| ||||
C、铜
| ||||
D、铜
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(l)△H=-Q1 2H2(g)+O2(g)=2H2O(g)△H=-Q2 | ||||
| B、S(s)+O2(g)=SO2(g)△H=-Q1 S(g)+O2(g)=SO2(g)△H=-Q2 | ||||
C、C(s)+O2(g)=CO2(g)△H=-Q1 C(s)+
| ||||
D、H2(g)+Cl2(g)=2HCl(g)△H=-Q1
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X与Y形成的化合物中,X可以显负价,Y显正价 |
| B、最高正化合价:X大于Y |
| C、第一电离能可能Y小于X |
| D、气态氢化物的稳定性:HmY小于HnX |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、1:2 |
| C、2:3 | D、1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
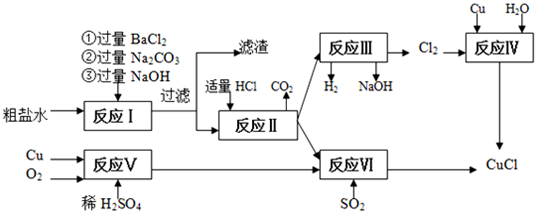
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com