


分析 (1)装置③干燥氨气选择和氨气不反应、不能溶解氨气的干燥剂;
(2)浓氨水和生石灰两种试剂制备氨气,可以利用浓氨水滴入生石灰中溶解放热一水合氨分解生成氨气,也可以加热氨水生成氨气;装置C为锥形瓶;
(3)NO与氨气反应生成氮气和水;反应中NO中的N元素得电子化合价降低;
(4)利用稀硝酸和碳酸钙反应生成二氧化碳气体充满试管,避免生成的一氧化氮被空气中的氧气氧化;
(5)检验铵根离子用浓的氢氧化钠和湿润的红色石蕊试纸;
(6)防止倒吸;装置⑦是用来检验氨气是否除净的装置,若氨气有剩余,在溶液中会生成沉淀.
解答 解:(1)装置③干燥氨气选择和氨气不反应、不能溶解氨气的干燥剂;
a.浓硫酸和氨气反应,不能干燥氨气,故a不符合;
b.碱石灰是碱性干燥剂,可以干燥氨气,故b符合;
c.无水氯化钙会和氨气结合不能干燥氨气,故c不符合;
故答案为:b.
(2)浓氨水和生石灰两种试剂制备氨气,可以利用浓氨水滴入生石灰中溶解放热一水合氨分解生成氨气,也可以加热氨水生成氨气,反应的化学方程式为:NH3•H2O$\frac{\underline{\;CaO\;}}{\;}$NH3↑+H2O或NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,则可以选择装置B或C;
故答案为:B或C;
(3)在加热和催化剂条件下,NO与氨气反应生成氮气和水,其反应的方程式为:6NO+4NH3$\frac{\underline{催化剂}}{△}$5N2+6H2O;反应中NO中的N元素得电子化合价降低,则NO为氧化剂;
故答案为:6NO+4NH3$\frac{\underline{催化剂}}{△}$5N2+6H2O;NO;
(4)利用稀硝酸和碳酸钙反应生成二氧化碳气体充满试管,把装置中的空气排净,可以避免生成的一氧化氮被空气中的氧气氧化;
故答案为:产生二氧化碳排尽装置中的空气,防止氧化NO;
(5)检验铵根离子先加浓的氢氧化钠,产生的氨气再用湿润的红色石蕊试纸检验;
故答案为:湿润的红色石蕊;
(6)装置⑥中,小段玻璃管的作用是防止氨气易溶于水发生倒吸现象;装置⑦是用来检验氨气是否除净的装置,硫酸亚铁和氨气反应生成白色沉淀氢氧化亚铁,若氨气未除净,⑦中溶液中会生成氢氧化亚铁沉淀,则溶液变浑浊;
故答案为:防倒吸;⑦中溶液变浑浊.
点评 本题考查了物质性质的实验验证和反应现象的判断应用,注意掌握常见气体的制备原理和方法以及常见物质的检验方法,题目难度中等,侧重于考查学生的实验探究能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
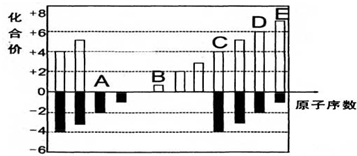
 铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题:
铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题: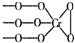 ,则Cr的化合价为+5.
,则Cr的化合价为+5.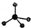 .CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为
.CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为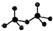 .则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.
.则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 醋酸 | 次氯酸 | 亚硝酸 |
| 电离常数 | 1.7×10-5 | 3.0×10-8 | 7.1×10-4 |
| A. | pH相同的氯水和亚硝酸溶液中水电离的c(H+)相同 | |
| B. | 向氯水中滴加氢氧化钠溶液至中性:c(Na+)=2 c(ClO-)+c(HClO) | |
| C. | 向漂白粉溶液中滴加H2SO3溶液可增强其漂白能力 | |
| D. | pH相同的醋酸钠、次氯酸钠和亚硝酸钠溶液中,c(Na+)最大的是亚硝酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
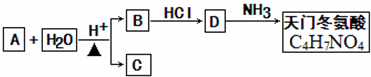
 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
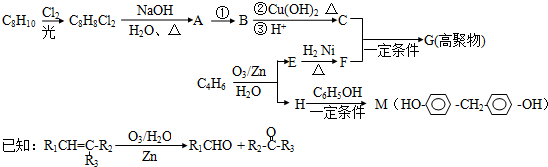
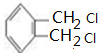
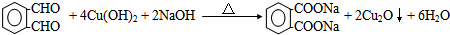
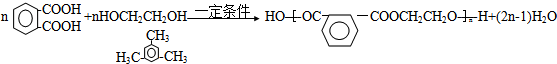
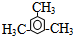 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由①只能确定溶液中有Al3+、Mg2+,没有HCO3- | |
| B. | 由②知溶液中有SO42-,没有Ba2+ | |
| C. | 由③确定溶液中有Na+,没有K+ | |
| D. | 若检验溶液中是否有存在Cl-,可取少许原溶液,直接向其中加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 己知X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,Y原子的最外层电子数是内层电子数二倍,Z能和X形成两种常见的液态化合物,W元素的单质既能与盐酸反应也能与NaOH溶液反应.元素Q是地壳中含量第二位的金属元素.试回答下列问题:
己知X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,Y原子的最外层电子数是内层电子数二倍,Z能和X形成两种常见的液态化合物,W元素的单质既能与盐酸反应也能与NaOH溶液反应.元素Q是地壳中含量第二位的金属元素.试回答下列问题: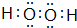 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源.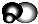 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com