
【题目】铁、铜及其化合物应用非常广泛。下列有关说法正确的是( )
A.地下钢管常用牺牲阳极的阴极保护法,阳极材料可用铜
B.反应Cu2S+O2![]() 2Cu+SO2,每生成1molCu转移电子数为6.02×1023
2Cu+SO2,每生成1molCu转移电子数为6.02×1023
C.反应2Cu+CO2+H2O+O2=Cu2(OH)2CO3室温下能自发进行,该反应的ΔH<0
D.室温下,Ksp[Fe(OH)3]=4×10-38,pH=4的含Fe3+溶液中,c(Fe3+)≤4×10-8mol·L-1
【答案】CD
【解析】
A. 地下钢管常用牺牲阳极的阴极保护法,阳极材料不能用铜,只能用比Fe活泼的金属,比如Mg,故A错误;
B. 反应Cu2S+O2![]() 2Cu+SO2,S化合价升高,Cu、O化合价降低,根据方程式生成2mol Cu转移6 mol电子,则每生成1molCu转移3 mol电子,即电子数为1.806×1024,故B错误;
2Cu+SO2,S化合价升高,Cu、O化合价降低,根据方程式生成2mol Cu转移6 mol电子,则每生成1molCu转移3 mol电子,即电子数为1.806×1024,故B错误;
C. 反应2Cu+CO2+H2O+O2=Cu2(OH)2CO3室温下能自发进行,根据方程式得出该反应ΔS<0,ΔG =ΔH-TΔS<0,根据低温下能自发进行,因此该反应的ΔH<0,故C正确;
D. 室温下,Ksp[Fe(OH)3]=4×1038,pH=4的含Fe3+溶液中,c(OH-)=1×1010mol·L1,![]() ,因此c(Fe3+) ≤ 4×108mol·L1,故D正确。
,因此c(Fe3+) ≤ 4×108mol·L1,故D正确。
综上所述,答案为CD。


科目:高中化学 来源: 题型:
【题目】在化学课上围绕浓硫酸的化学性质进行如下实验探究,将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。请回答下列问题:
(1)生成的这种黑色物质(单质)是(填化学式)____________________。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的污染物之一,这种刺激性气味气体为(填化学式)_________,反应的化学方程式为________。
(3)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填字母) _______。
A.酸性 B.吸水性
C.脱水性 D.强氧化性
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液_______,说明这种气体有______性;将(2)中产生的有刺激性气味的气体通入氯水中,发生反应的化学方程式为_______。
(5)能否用澄清石灰水鉴别(2)中产生的两种气体 (填“能”或“不能”)________,若不能,请写出两种可以鉴别这两种气体的试剂:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸(0.1000mol/L)来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握_______(填“酸式”或“碱式”)滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________直到加入最后一滴盐酸后,溶液由黄色变为_________色,并_________________________为止。
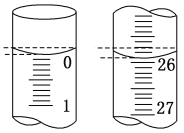
(2)滴定开始和结束时滴定管的液面如图所示,则终点读数为_____mL;所用盐酸体积为_____mL。
(3)对下列几种假设情况进行讨论:(填“偏高”、“偏低”或“无影响”)
①若滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,则可能使所测NaOH溶液的浓度数值_________;
②若酸式滴定管在滴定前有气泡,滴定后气泡消失,则可能使所测NaOH溶液的浓度数值_______。
(4)有关数据记录如下:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.50 | 25.40 |
第二次 | 20.00 | 0.00 | 25.10 |
根据所给数据,计算出待测NaOH溶液的浓度为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅
B. NO2和N2O4平衡混合气缩小体积加压后颜色先变深后变浅一点
C. 氢气和碘蒸气反应达平衡后加压颜色加深
D. 硫酸工业上SO2氧化成SO3,通入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从碘的四氯化碳溶液中分离并得到单质碘,主要步骤为:用浓NaOH溶液进行反萃取(3I2+6OH-=5I-+IO![]() +3H2O)、分液、酸化(5I-+IO
+3H2O)、分液、酸化(5I-+IO![]() +6H+=3I2↓+3H2O)、过滤及干燥等。下列有关实验原理和装置不能达到实验目的的是( )
+6H+=3I2↓+3H2O)、过滤及干燥等。下列有关实验原理和装置不能达到实验目的的是( )

A.用装置甲反萃取时,倒转振荡过程中要适时旋开活塞放气
B.用装置乙分液时,先放出有机相,关闭活塞,从上口倒出水相
C.用装置丙从酸化后的体系中分离出单质碘
D.用装置丁干燥单质碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用电解熔融氧化铝来制取金属铝,关于该反应的下列说法不正确的是
A.属于分解反应
B.属于氧化还原反应
C.金属铝是氧化产物
D.说明氧化铝是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在复习铁的冶炼时,在参考资料上发现以下一段文字:已知在不同的温度下,一氧化碳与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和二氧化碳,他们不禁产生了疑问:一氧化碳与氧化铁反应生成的黑色物质真的是铁粉吗?于是他们进行了以下探究:
[查阅资料]
资料一:铁粉和四氧化三铁粉末能被磁铁吸引而氧化亚铁(黑色)不能;
资料二:四氧化三铁中铁元素有+2、+3两种化合价,其化学式可用FeO·Fe2O3的形式表示。
[提出猜想]黑色物质可能是四氧化三铁、氧化亚铁和铁粉中的一种或几种。
[进行实验]兴趣小组收集了一氧化碳与氧化铁反应生成的黑色物质进行了下列实验:
实验方案 | 实验现象 | |
甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变为黄绿色 |
丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |
[实验结论]
(1)甲实验现象说明黑色物质中没有_______,乙、丙实验现象说明黑色物质中没有______;
(2)生成的黑色物质应为四氧化三铁;
(3)写出黑色粉末和热的盐酸反应的化学方程式_______________________________。
[拓展研究]
同学们对四氧化三铁产生了兴趣,从参考资料中找到氧化沉淀法生产复印用高档四氧化三铁粉的工艺流程简图。
[生产流程]

[查阅资料]
资料一:硫酸亚铁在不同温度下的溶解度如下表所示:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料二:氢氧化亚铁受氧气氧化反应原理为4Fe(OH)2+2H2O+O2===4Fe(OH)3
资料三:获得四氧化三铁的反应原理为Fe(OH)2+2Fe(OH)3![]() Fe3O4+4H2O
Fe3O4+4H2O
[问题讨论]
(1)溶解时,用50 ℃至80 ℃的热水目的是____________________________________。
(2)写出加入适量氢氧化钠溶液时发生反应的化学方程式________________________。
(3)上述过程中,要控制“通一定量空气”的目的是____________________________。
(4)要使四氧化三铁的产率最高,则上述流程中产生的氢氧化亚铁和氢氧化铁的最佳质量比为______________。
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→_____→_____→d。_______
a.过滤
b.加热浓缩
c.冷却结晶
d.晶体加热至完全失去结晶水
[组成确定]
为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究。
[查阅资料]
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:氧化铁和一氧化碳反应是随温度升高而逐步进行的,先生成四氧化三铁,再生成氧化亚铁(黑色),最后生成铁。
[提出猜想]
四氧化三铁中可能含有的杂质是氧化铁和氧化亚铁中的一种或两种。
[实验设计]
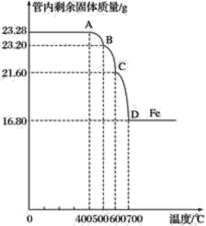
同学们称取了23.28 g该四氧化三铁样品进行了下列实验:

[实验分析]
因探究思路不同,兴趣小组分成甲、乙两小组。
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该四氧化三铁样品中的杂质,B中的最佳试剂是_________(填序号)。
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,一氧化碳气体除作为反应物外,还能起到的作用是:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;
③_____________________________________________。
(3)乙组同学认为B装置反应前后的质量差会偏小而影响计算、分析,你认为他们的理由是_______________________________________________。
乙组:
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(如图):
(1)写出BC段发生反应的化学方程式______________________________。
(2)通过计算确定:该四氧化三铁样品中含有的杂质是__________,其中含四氧化三铁的质量是____g。(不需要写过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室中探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,现象如下:

下列有关三种金属的说法中正确的是( )
A.三种金属的活泼性由强到弱的顺序是Ti、Mg、Cu
B.若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.Cu和MgCl2溶液不发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钾离子电池的工作原理如图所示,下列说法正确的是

A.放电时,负极的电极反应式 :KC6 –e- =K ++6C
B.充电时,阳极的电极反应式 :K0.5-xMnO2+xK++ xe-=K0.5MnO2
C.放电时,K+ 通过阳离子交换膜向石墨电极移动
D.若仅把钾离子换成锂离子,当负极减少的质量相同时,钾离子电池转移的电子数比锂离子电池的多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com