
 A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,C原子最外层电子数是其电子总数的$\frac{1}{3}$;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第10列.
A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,C原子最外层电子数是其电子总数的$\frac{1}{3}$;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第10列.
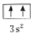 违背了泡利原理.
违背了泡利原理.分析 A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大,A元素原子的核外p电子数比s电子数少1,电子排布为1s22s22p3,即A为N;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,则其电子排布为1s22s22p63s2,故B为Mg;C原子最外层电子数是其电子总数的$\frac{1}{3}$,核外电子排布为1s22s22p63s23p3符合题意,即C为P;D元素的主族序数与周期数的差为4,原子序数大于P,则D为第三周期第ⅦA族元素,即D为Cl;E是前四周期中电负性最小的元素,则E为K;F处于第四周期,且在第10列,则F为Ni,据此解答.
解答 解:A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大,A元素原子的核外p电子数比s电子数少1,电子排布为1s22s22p3,即A为N;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,则其电子排布为1s22s22p63s2,故B为Mg;C原子最外层电子数是其电子总数的$\frac{1}{3}$,核外电子排布为1s22s22p63s23p3符合题意,即C为P;D元素的主族序数与周期数的差为4,原子序数大于P,则D为第三周期第ⅦA族元素,即D为Cl;E是前四周期中电负性最小的元素,则E为K;F处于第四周期,且在第10列,则F为Ni.
(1)A为N,能量最高的电子为2p电子,其电子云在空间有3个方向,p轨道为纺锤形,故答案为:3;纺锤形;
(2)由泡利原理可知,电子在同一轨道内的自旋方向应相反,B基态原子的核外电子排布图中3s上的两个电子自旋方向相同,则违反了泡利原理,
故答案为:泡利;
(3)F为Ni,在第四周期第Ⅷ族,最后填充的为d电子,在d区,核外电子数为28,有28种运动状态不同的电子,
故答案为:Ⅷ;d;28;
(4)PCl3中P原子孤电子对数为1,成键数为3,则为sp3杂化,空间构型为三角锥形,E为K,检验K元素应利用焰色反应,
故答案为:sp3;三角锥形;焰色反应;
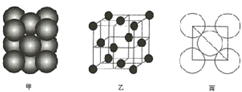
(5)由晶胞结构可知,以顶点原子研究,与之最近的原子处于面心上,每个顶点原子为12个面共用,故晶胞中该原子的配位数为12,该单质晶体中原子的堆积方式为面心立方最密堆积,
故答案为:12;面心立方最密堆积.
点评 本题是对物质结构与性质的考查,难度中等,注意原子结构知识在元素推断中的重要性,学生应熟悉电子的排布、空间构型、杂化等知识点,识记中学常见的晶胞结构.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
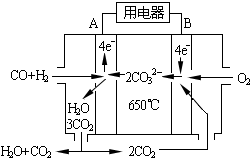 (6)工业上可回收CO作燃料.如图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.A为电池的负(填“正”或“负”)极,写出B极电极反应式:2CO2+O2+4e-=2CO32-.
(6)工业上可回收CO作燃料.如图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.A为电池的负(填“正”或“负”)极,写出B极电极反应式:2CO2+O2+4e-=2CO32-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl->c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol/L NH4Cl溶液与5mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO${\;}_{4}^{2-}$、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2和1mol I2完全反应放出4.5kJ热量 | |
| B. | 1个氢分子和1个碘分子完全反应放出9kJ热量 | |
| C. | 1molH2和1mol I2完全反应生成气态HI放出9kJ热量 | |
| D. | 0.5mol H2和0.5mol I2完全反应需要吸收4.5kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将海水蒸馏淡化为饮用水 | |
| B. | 四氯化碳萃取碘水中的碘 | |
| C. | 过滤除去粗盐溶液中的不溶性杂质 | |
| D. | 三氯化铁溶液滴入沸水中可制得氢氧化铁胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com