
| A. | 食盐熔化 | B. | 晶体硅熔化 | C. | 碘升华 | D. | 氢氧化钠熔化 |
科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | C2H4 | C. | C3H8 | D. | C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
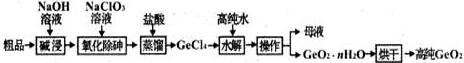
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物在生产、生活中有着重要作用.
氮及其化合物在生产、生活中有着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
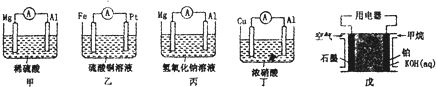
 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.某兴趣小组的实验数值结果大于57.3kJ•mol-1(中和热),原因可能是( )
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.某兴趣小组的实验数值结果大于57.3kJ•mol-1(中和热),原因可能是( )| A. | 实验装置中小烧杯杯中低于大烧杯杯口 | |
| B. | 用浓硫酸代替了稀硫酸 | |
| C. | 分多次把NaOH溶液倒入盛有硫酸的小烧杯中 | |
| D. | 用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 化学键的常见类型为离子键、共价键和氢键 | |
| D. | 离子化合物中一定含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
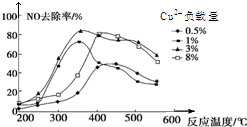 雾霾严重影响人们的生活,汽车尾气的排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:
雾霾严重影响人们的生活,汽车尾气的排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com