
| A. | 正极 | B. | 负极 | C. | 阳极 | D. | 阴极 |
科目:高中化学 来源: 题型:选择题
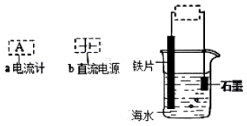
| A. | 接a,该装置将化学能转化为电能 | B. | 接a,石墨是正极 | ||
| C. | 接b,铁片连正极时被保护 | D. | 接b,石墨连正极时石墨上产生气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
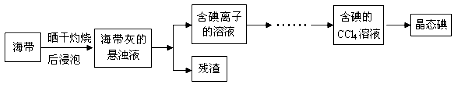
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去Cl2中的HCl:将混合气体通过AgNO3溶液 | |
| B. | 除去C2H6中的C2H4:将混合气体通过酸性KMnO4溶液 | |
| C. | 检验CO2中是否混有HCl:将气体通入饱和NaHCO3溶液 | |
| D. | 检验Cl2中是否混有空气:将装有气体的试管倒置在NaOH溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D |
| 性质 结构 信息 | 单质银白色,燃烧时火焰呈黄色. | 其单质是空气的主要成分,化学性质非常稳定. | 原子的3p亚层上有5个电子. | +2价阳离子的核外电子排布与氖原子相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10与C3H6 | B. | C5H12与C2H6O | C. | C2H2Cl4与CH2Cl2 | D. | CH2O与C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
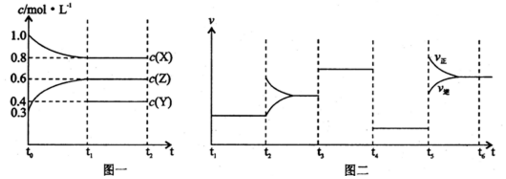
| A. | Y的起始物质的量为0.5 mol | |
| B. | 该反应的化学方程式为:2X(g)+Y(g)?3Z(g)△H<0 | |
| C. | 若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L•s) | |
| D. | 反应物X的转化率t6点比t3点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:Z>W | |
| B. | 简单离子半径:X>W | |
| C. | 元素X与氧可形成既含离子键也含非极性共价键的化合物 | |
| D. | X、Y、Z的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com