
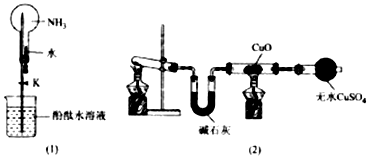
分析 (1)实验室用加热氯化铵与氢氧化钙固体制备氨气;
(2)①氨气是极易溶于水的气体,使烧瓶内产生压强差导致溶液进入烧瓶,就会产生喷泉;
②氨气与水反应生成一水合氨,一水合氨为弱碱,部分电离生成氨根离子和氢氧根离子,溶液呈碱性;
(3)氨气与铜在加热条件下发生氧化还原反应生成氮气和铜.
解答 解:(1)加热氯化铵与氢氧化钙固体反应生成氯化钙、氨气和水,化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)①NH3极易溶解于水,打开止水夹挤出胶头滴管中的水,然后打开止水夹K,由于氨气迅速溶解导致烧瓶内气体压强迅速减小,导致溶液进入烧瓶产生喷泉现象,
故答案为:轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K;
②氨气与水反应生成一水合氨,一水合氨为弱碱,部分电离生成氨根离子和氢氧根离子,溶液呈碱性,离子方程式:NH3+H2O?NH3•H2O?NH4++OH-,使烧杯中酚酞溶液由无色变为红色,
故答案为:NH3+H2O?NH3•H2O?NH4++OH-;
(3)氨气与铜在加热条件下发生氧化还原反应,无色气体为氮气,生成氮气和铜,化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
点评 本题考查了氨气的制备和性质的检验,熟悉制备原理是解题关键,注意实验室制取氨气的原理是高频考点,题目难度不大.


科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
将如图所示实验装置的K闭合,下列叙述正确的是
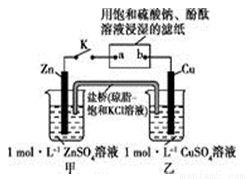
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(S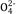 )增大
)增大
D.片刻后可观察到滤纸b点变红
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:填空题
请完成下列填空:
(1)当SO2和SO3中分子个数比为1:1 时,原子总数之比为____________,质量之比为____________.
(2)中和含0.2mol HCl的稀盐酸,需NaOH的质量为____________g.
(3)同温同压下,同体积的NH3和H2S气体的质量比是________________;同质量的NH3和H2S气体的体积比是_____________;同质量的NH3和H2S气体中所含氢原子个数比是 ____________;若两者所含氢原子个数相等,它们的物质的量比是__________.
(4)将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3﹣的物质的量浓度是______mol•L﹣1.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
某实验报告记录了如下数据,其中数据合理的是( )
A. 用pH试纸测得氯水的pH为2.1 B. 用50mL量筒量取23.00mL浓盐酸
C. 用温度计测量出酒精的沸点为78.5℃ D. 用托盘天平称量氧化铜粉末为11.70g
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,向饱和MgF2溶液中加入饱和NaOH溶液后,不可能有Mg(OH)2生成 | |
| B. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大 | |
| C. | 25℃时,Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的Ksp相比较,前者小 | |
| D. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0~5min内,v(CO2)=0.16mol•L-1•min-1 | |
| B. | 氨气体积分数不变时,该反应一定达到平衡状态 | |
| C. | 平衡后,缩小容器容积,重新建立平衡时,c(CO2)增大 | |
| D. | 其他条件不变,若将原容器改为绝热容器,则达到平衡时,NH2COONH4的转化率小于80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com