
【题目】PH3是粮食杀虫处理时常用的熏蒸杀虫剂;水煤气变换时产生的PH3能使催化剂中毒,必须脱除。回答下列问题:
(1)PH3通入NaClO溶液脱除PH3时,氧化产物是一种含氧酸且反应中氧化剂与还原剂的物质的量之比为4:1,则该含氧酸的化学式为______。
(2)已知下列键能数据及P4(白磷)分子结构:
化学键 | P-P | H-H | P-H |
|
键能/(kJmol-1) | 213 | 436 | 322 |
则反应4PH3(g)P4(g)+6H2(g)△H=______kJmol-1;某温度时平衡体系中c(PH3)=0.25molL-1,c(H2)=c(P4)=0.50molL-1,则平衡常数K=______。
(3)文献报道“反应6.25CO2(g)+Fe3O4(s)+3PH3(g)=3FePO4(s)+4.5H2O(g)+6.25C(s)”是铁触媒中毒的主导反应,其平衡常数Kp(Kp为以分压表示的平衡常数)的对数值与温度的关系如图所示:
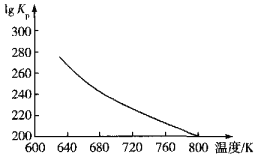
①该反应的△H______0(填“>”“<”或“=”)。
②图中lgKp=______[列出用分压p(CO2)、p(PH3)、p(H2O)表示的计算式]。
(4)反应(CH3)3AuPH3→(CH3)AuPH3+C2H6的历程如下:
第一步:(CH3)3AuPH3![]() (CH3)3Au+PH3(快反应)
(CH3)3Au+PH3(快反应)
第二步:(CH3)3Au![]() C2H6+CH3Au(慢反应)
C2H6+CH3Au(慢反应)
第三步:CH3Au+PH3![]() (CH3)AuPH3(快反应)
(CH3)AuPH3(快反应)
①反应的中间产物有PH3、______。
②第______步(填“一”“二”或“三”)反应的活化能最大。
(5)用Cu2+、Pd2+液相脱除PH3的反应为:PH3+2O2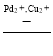 H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
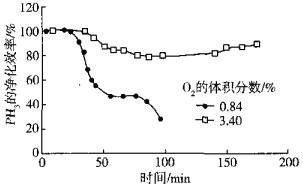
O2的体积分数大,PH3的净化效率高的原因是______(用碰撞理论等说明)。
【答案】H3PO4 -30 2 < 4.5lgP(H2O)-6.25lgP(CO2)-3lgP(PH3)或lg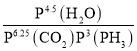 (CH3)3Au和CH3Au 二 O2的体积分数越大,有效碰撞的几率增加,氧化更多的PH3,净化效率高
(CH3)3Au和CH3Au 二 O2的体积分数越大,有效碰撞的几率增加,氧化更多的PH3,净化效率高
【解析】
(1)由题意,PH3通入NaClO溶液脱除PH3时,氧化产物是一种含氧酸,PH3作还原剂,NaClO作氧化剂,该含氧酸为磷酸,又因为反应中氧化剂与还原剂的物质的量之比为4:1,则反应中NaClO的系数为4,PH3和H3PO4系数为1,根据质量守恒和得失电子守恒,还原产物为NaCl,计量系数为4,化学反应方程式为:4NaClO+PH3=H3PO4+4NaCl,
答案为:H3PO4;
(2)反应热=反应物键能-生成物键能,根据表格数据和物质结构△H=3×4×322 kJmol-1-6×213 kJmol-1-6×436 kJmol-1=-30 kJmol-1;根据反应4PH3(g)P4(g)+6H2(g),该反应平衡常数表达式为K=![]() =
= =
=![]() =2
=2
答案为:2;
(3)①根据图像,温度越高,平衡常数Kp的对数值越小,则平衡常数Kp越小,说明反应向逆向移动,因此该反应正向为放热反应,△H<0;
答案为:<;
②根据反应6.25CO2(g)+Fe3O4(s)+3PH3(g)=3FePO4(s)+4.5H2O(g)+6.25C(s),用压强表示该反应的平衡常数的表达式为Kp=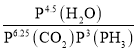 ,则lgKp= lg
,则lgKp= lg ;
;
答案为:lg 或4.5lgP(H2O)-6.25lgP(CO2)-3lgP(PH3)
或4.5lgP(H2O)-6.25lgP(CO2)-3lgP(PH3)
(4)①根据反应历程,第一步+第二步+第三步反应可得(CH3)3AuPH3→(CH3)AuPH3+C2H6,则中间产物有PH3、CH3Au、(CH3)3Au;
答案为:CH3Au、(CH3)3Au;
②反应的活化能越大,该反应需要的能量越多,反应进行需要的时间越长,即反应进行的慢,活化能越高,根据反应历程,第二步是慢反应,活化能最大;
答案为:二;
(5)根据图像显示,当氧气的体积分数较大时,PH3的净化效率高,利用碰撞理论来分析,O2的体积分数越大,单位体积内有效碰撞的几率增加,能氧化更多的PH3,净化效率高。
答案为:O2的体积分数越大,有效碰撞的几率增加,氧化更多的PH3,净化效率高。


科目:高中化学 来源: 题型:
【题目】下列反应中,第一步反应生成的沉淀经第二步反应后质量增加的是( )
A.将少量![]() 溶液加入NaOH溶液中,再滴加
溶液加入NaOH溶液中,再滴加![]() 溶液
溶液
B.将少量![]() 溶液滴加到NaCl溶液中,再滴加
溶液滴加到NaCl溶液中,再滴加![]() 溶液
溶液
C.将少量![]() 通入饱和
通入饱和![]() 溶液中,再通入过量
溶液中,再通入过量![]()
D.将少量![]() 溶液滴加到
溶液滴加到![]() 溶液中,再加入过量NaOH溶液
溶液中,再加入过量NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“信阳毛尖”是一种绿茶,绿茶中含有的单宁酸(化学式为C76XnO46)具有抑制血压上升、清热解毒等功效。回答下列问题:
(1)已知单宁酸完全燃烧时得到CO2、H2O,则X代表______元素,单宁酸的摩尔质量是1700g·L-1,则n=______,170g单宁酸完全燃烧时可得到______gH2O。
(2)若170g单宁酸某次燃烧时生成了3.6molCO2,则生成的CO最多______g,此种情况下恢复到常温,所得混合气体的平均摩尔质量为______(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证浓硫酸和木炭粉在加热条件下产生的产物,某同学选用了如图所示的实验装置。下列说法错误的是( )
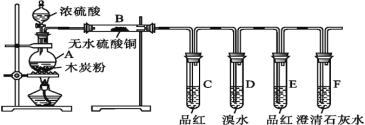
A.B装置用来检验产物中是否有水蒸气生成
B.C装置用来检验产物中是否有SO2生成
C.F装置用来检验产物中是否有CO2生成
D.将装置B与C位置互换,仍可以达到实验目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属A及其化合物之间有如下的转化关系:

(1)请写出A、B、C的化学式:A.__________;B.__________;C._________
(2)写出A与B反应的离子方程式:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4晶体是一种易溶于水的微红色晶体,某校同学设计实验制备并检验MnSO4的性质。回答下列问题:
(1)甲组同学设计用SO2和适量纯净的MnO2制备MnSO4,其装置如下:
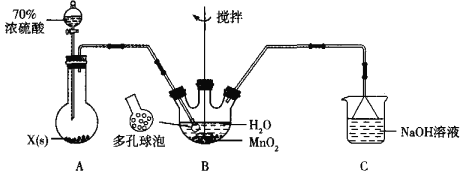
①A装置中固体药品X通常是______填化学式)。
②B装置中通SO2的导管末端接多孔球泡的目的是______;C装置用于吸收少量的SO2,发生反应的离子方程式为______。
(2)乙组同学定性检验甲组同学的产品中Mn2+的存在,取少量晶体溶于水,加入(NH4)2S2O8溶液,滴入硝酸银(作催化剂),微热振荡,溶液显紫色,发生反应的离子方程式为______。
(3)丙组同学为检验无水MnSO4(接近白色)的热分解产物,将MnSO4晶体脱水后放入下图所示的装置中,打开K1和K2,缓慢通入N2,加热,硬质玻璃管中最后得到黑色固体。
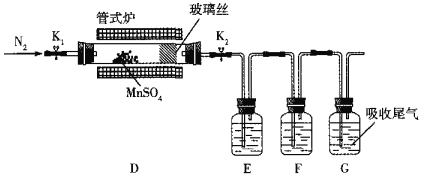
①检验分解的气态产物中是否有SO2及SO3,装置E、F中的溶液依次是______、______(填字母)。
a.Ba(NO3)2溶液b.BaCl2溶液c.品红溶液d.浓硫酸
②若D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,则D中发生反应的化学方程式为______。
(4)丁组同学设计实验以丙组同学得到的黑色粉末为原料,利用铝热反应原理将其还原为金属锰,所需的药品除氯酸钾外,还需要______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为___________________________。
(2)元素C与元素D以原子个数比为1∶1形成化合物Q,请写出Q的电子式为_______。
(3)用电子式表示化合物D2C的形成过程_____________________。
(4)元素A、B、C以原子个数比为4∶2∶3形成化合物W,化合物W中存在的化学键有____________________。
(5)写出碳单质与E的最高价氧化物对应水化物浓溶液反应的化学方程式为____________,当转移电子为0.2 mol时,标准状况下反应产生气体_______________L。
(6)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接甲醇燃料电池 (DMFC) 具备低温快速启动、燃料洁净环保以及电池结构简单等特性。这使得直接甲醇燃料电池(DMFC)可能成为未来便携式电子产品应用的主流。如图以甲醇为燃料的新型电池是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

(1)如图中的B极上的电极反应式为______。
(2)若用上述甲醇燃料电池做电源,用惰性电极电解100mL,5mol·L-1硫酸铜溶液,当阳极收集到3.36L(标准状况)气体时,消耗甲醇的质量为____g,此时可向电解后的溶液中加入_____使溶液复原。请写出电解硫酸铜溶液的电解反应化学方程式____。
(3)若用上述甲醇燃料电池做电源,用石墨做电极在一定条件下电解饱和食盐水制取NaOH。

①如图电解池的电极a接甲醇燃料电池的_____极( 填A或B) ,写出阳极的电极反应式:_____。假设电解时还产生一种黄绿色气体二氧氯(ClO2),写出阳极产生ClO2的电极反应式_________。
②电解一段时间,当阴极产生的气体体积为224 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R 是 6 种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)元素 X 在元素周期表中的位置是_____
(2)元素 M 组成的单质的电子式为_____
(3)单质铜和元素M的最高价氧化物对应水化物的稀溶液发生反应的离子方程式为_________________
(4)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是_____
(5)元素Q、元素 Z 的含量影响钢铁性能,若钢样中元素 Z 以 FeZ 的形式存在,高温下在过量空气中反应生成ZO2和一种红棕色的氧化物,则反应的化学方程式是_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com