
【题目】卤素单质从F2到I2,在常温、常压下的聚集状态由气态、液态到固态的原因是 ( )
A. 原子间的化学键键能逐渐减小
B. 范德华力逐渐增大
C. 原子半径逐渐增大
D. 氧化性逐渐减弱
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:
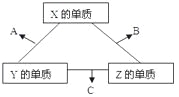
一个B分子中含有的Z原子个数比C分子少1个,B、C 两种分子中的电子数均等于10。
请回答下列问题:
(1)X元素在周期表中的位置是________________.
(2)B分子的电子式为________________。分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在_______________。
(3)已知Y+Z→C是一个可逆反应,其平衡常数表达式为_______________。有甲、乙两容器,容器容积固定,乙容器容积可变。一定温度下,在甲中加入2,molY、3molZ,反应达到平衡时生成C的物质的量为mmol。相同温度下,在乙中加入4 mol Y、6 mol Z,若乙的压强始终与甲的压强相等,乙中反应达到平衡时,生成C的物质的量为________mol(从下列各项中选择,只填字母,下同);若乙的容积与甲的容积始终相等,乙中反应达到平衡时,生成C的物质的量为________mol。
A.小于m
B.等于m
C.在m~2m之间
D.等于2m
E.大于2m
(4)Y的最高价氧化物的水化物为W,其溶液呈黄色,其原因是________________(写化学方程式);W与C在适当条件下被W吸收生成一种盐Q,该盐的水溶液pH<7,其原因是(写出离子方程式)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 工业上用Cl2和石灰水为原料生产漂白粉
B. “霾尘积聚难见路人”,雾霾所形成的气溶胶具有丁达尔效应
C. 氢氧化铁胶体用于饮用水的净化、消毒
D. 将饱和FeCl3溶液滴入NaOH溶液中制备Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨分子、水分子、甲烷分子中共价键的键角分别为a、b、c,则a、b、c的大小关系为
A. a<b<c B. c<b<a
C. b<c<a D. b<a<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) 下列叙述错误的是( )
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是( )
A.使用催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于平衡常数K与化学平衡移动的关系叙述正确的是( )
A. K值不变,平衡不会移动 B. K值变化,平衡一定移动
C. 平衡移动,K值一定变化 D. 平衡移动,K值一定不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有250C 101KPa条件下的氯化氢(HCl)气体49L(注:250C 101KPa条件下气体摩尔体积为24.5L/mol)则:
①该气体所含原子总数为____________。
②该气体的质量为____________g。
③该气体溶于127mL水中,得到密度为1.20g/mL的盐酸,此盐酸的物质的量浓度为______________。
④取出20.0 mL该溶液,配成浓度为2.00 mol/L的稀溶液,则稀释后溶液的体积是________ ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上湿法制高铁酸钾的基本流程如下:
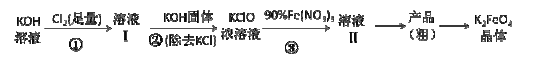
已知:高铁酸盐热稳定性差
回答下列问题:
(1)第③步发生反应的离子方程式 。
(2)第③步反应的体系,温度不宜过高,并最好控制温度在 30℃以下,其原因是 。
(3)通过结晶方法从溶液II得到的粗产品中主要含有杂质 (填化学式),可通过重结晶法提纯K2FeO4,具体操作步骤有:将粗产品先用饱和KOH溶液溶解,然后浓缩、冷却结晶、过滤、洗涤、干燥。其干燥可采用的方法是 (写出一种干燥方法)。
(4)利用电化学原理,用铁钉和氢氧化钾溶液为原料可以获得K2FeO4。在制备过程中铁钉作______极,请写出获得FeO42-的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种正盐的混合溶液中含有0.2mol Na+、0.25mol Mg2+、0.4mol Cl﹣ , 则SO42﹣的物质的量为( )
A.0.5 mol
B.0.3 mol
C.0.15 mol
D.0.1 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com