
已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10-12,取适量的MgCl2溶液,
加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
A.所得溶液中的c (H+)=10-13mol/L
B.所得溶液中由水电离产生的c (OH-)=10-13 mol/L
C.所加的烧碱溶液的pH=13.0
D.所得溶液中的c (Mg2+)=5.6×10-10 mol/L
科目:高中化学 来源: 题型:
(1)反应aA(g)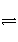
 bB(g)+cC(g)在一容积不变的容器内进行,反应达到平衡后(以下填“增大”、“减小”或“不变”):
bB(g)+cC(g)在一容积不变的容器内进行,反应达到平衡后(以下填“增大”、“减小”或“不变”):
①若a=b+c,增大A的浓度,A的转化率________。
②若a>b+c,增大A的浓度,A的转化率________。
(2)若反应aA(g)+bB(g)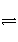
 cC(g)+dD(g),容器体积固定不变,且起始时A与B的物质的量之比为a∶b。
cC(g)+dD(g),容器体积固定不变,且起始时A与B的物质的量之比为a∶b。
①平衡时A与B的转化率之比是________。
②若增大A的浓度,则A的转化率________。
③若同时同等倍数地增大A、B的浓度,则a+b与c+d满足什么关系时,A与B的转化率同时增大?a+b______c+d(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
为达到相应的实验目的,下列实验的设计或操作最合理的是( )
A.为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值
B.为观察Mg条在CO2气体中的燃烧,在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部。
C.为比较HA和HB两种弱酸的Ka大小,可用pH计测定同温同浓度的NaA溶液和NaB 溶液的pH值
D.为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用甲基橙作指示剂,用标准盐酸溶液滴定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于溶液和胶体的叙述,正确的是
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
查看答案和解析>>
科目:高中化学 来源: 题型:
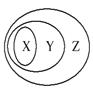
用下图表示的一些物质或概念间的从属关系中不正确的是( )
| X | Y | Z | |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 置换反应 | 氧化还原反应 | 离子反应 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
A.0.1 mol·L-1 pH=7.82的NH4HCO3溶液中:c(HCO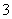 )>c(NH
)>c(NH )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.浓度均为0.1 mol·L-1的NH3·H2O溶液和NH4Cl溶液等体积混合:
[c(NH )+c(H+)]>[c(NH3·H2O)+c(OH-)]
)+c(H+)]>[c(NH3·H2O)+c(OH-)]
C.0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
D.0.1 mol·L-1 Na2S溶液与0.1 mol·L-1 NaHS溶液等体积混合:
2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:反应①Fes)+CO2g)FeOs)+COg)的平衡常数为K1;反应②Fes)+H2Og)FeOs)+H2g)的平衡常数为K2,不同温度下K1、K2的值如表中所示:
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1 173 K | 2.15 | 1.67 |
请回答下列问题:
1)从表中数据可以推断:反应①是________填“吸”或“放”)热反应。
2)现有反应CO2g)+H2g)COg)+H2Og),写出该反应的平衡常数K3的数学表达式:________。
3)根据反应①与②,可推导出K1、K2与K3之间的关系式。据此关系式及表中数据,也能推断出反应③是吸热反应还是放热反应。欲使反应③在一定条件下建立的平衡向正反应方向移动,可采用的措施有________填序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
查看答案和解析>>
科目:高中化学 来源: 题型:
能说明元素X原子的得电子能力强于元素Y原子的得电子能力的事实是
)。
A.元素周期表中元素X位于元素Y的上一周期
B.元素X的含氧酸的酸性强于元素Y的含氧酸的酸性
C.分别加热H2X、HY至500 ℃,只有HY发生分解
D.元素X与Y同主族,相同温度时其单质与铜反应分别生成Cu2X和CuY
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应:A===B+C在室温下不能自发进行,在高温下能自发进行,对该反应过程ΔH、ΔS的判断正确的是( )
A.ΔH<0、ΔS<0 B.ΔH>0、ΔS<0
C.ΔH<0、ΔS>0 D.ΔH>0、ΔS>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com