
| 氟化物 | G的氟化物 | Q的氟化物 |
| 熔点/K | 993 | 1539 |
分析 原子序数依次增大的X、Y、Z、G、Q、R六种主族元素,核电荷数均小于36.由X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面,可知氢化物为乙烯,则X为C元素;Z的L层上有2个未成对电子,L层电子排布为2s22p4,则Z为O元素,结合原子序数可知Y为N;Q原子s能级与p能级电子数相等,则Q的电子排布为1s22s22p63s2,则Q为Mg元素,R单质是制造各种计算机、微电子产品的核心材料,R为Si,结合G的原子序数及形成氟化物可知G为Na,以此来解答.
解答 解:由上述分析可知,X为C,Y为N,Z为O,G为Na,Q为Mg,R为Si,
(1)C的电子排布为1s22s22p2,共有6种不同运动状态的电子,有1s、2s、2p共3种不同能级的电子,故答案为:6;3;
(2)非金属性越强,第一电离能越大,但N的2p电子半满为稳定结构,则X、Y、Z的第一电离能由小到大的顺序为C<O<N,故答案为:C<O<N;
(3)Z与R能形成化合物甲为SiO2,1个Si的周围有4个Si-O键,1mol甲中含4mol化学键,故答案为:4;
(4)由表格数据可知,Q的氟化物熔点高,造成熔点差异的原因为NaF与MgF2为离子晶体,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高,故答案为:NaF与MgF2为离子晶体,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、电子排布规律来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.9mol/L | B. | 1.8mol/L | C. | 2.1mol/L | D. | 1.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. +
+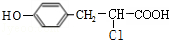 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;写出化合物EDA的电子式
;写出化合物EDA的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com