
(10分)铝是一种重要金属:(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:
(2)工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3 ,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
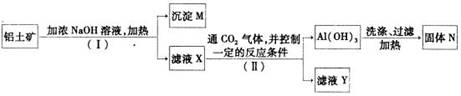
①I和II步骤中分离溶液和沉淀的操作是; ;
②沉淀M中除含有泥沙外,一定还含有 ,固体N是 ;
③滤液X中,含铝元素的溶质的化学式为 ,它属于 (填“酸”、“碱”或“盐”)类物质;
④实验室里常往AlCl3溶液中加入 (填“氨水”或“NaOH溶液”)来制取
A1(OH)3。其反应的离子方程式为:___________________________________________。
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)铝是一种重要金属:(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:
(2)工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3 ,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
①I和II步骤中分离溶液和沉淀的操作是; ;
②沉淀M中除含有泥沙外,一定还含有 ,固体N是 ;
③滤液X中,含铝元素的溶质的化学式为 ,它属于 (填“酸”、“碱”或“盐”)类物质;
④实验室里常往AlCl3溶液中加入 (填“氨水”或“NaOH溶液”)来制取
A1(OH)3。其反应的离子方程式为:___________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省厦门六中高一下学期期中考试化学试卷(带解析) 题型:实验题
铝是一种重要金属,从铝土矿(主要成分为Al2O3,Fe2O3、SiO2等)中冶炼Al的工业生产流程如下图: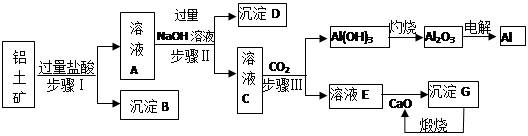
(1)沉淀B的化学式为 ,溶液A中含的阳离子主要有 。
(2)写出步骤II生成溶液C 的离子方程式 ,
步骤I、II、III都要用到的分离方法是 。
(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有: (填化学式)。
(4)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:
(5)经分析,a吨铝土矿可以冶炼出b吨的铝(假设各生产环节中无损耗),则原铝土矿中Al2O3的纯度(质量分数) (用含a、b的最简式表示)。
查看答案和解析>>
科目:高中化学 来源:2013届云南大理云龙一中高二上学期期末考试化学试卷 题型:填空题
(8分) (1)下列实验方法合理的是 (多选或错选不给分)
A、用加热法除去食盐固体中的氯化铵
B、将碘的饱和水溶液中的碘提取出来,可用酒精进行萃取
C、实验室制取Al(OH)3: 往AlCl3溶液中加入NaOH溶液至过量
D、往FeCl2溶液中滴入KSCN溶液,检验FeCl2是否已氧化变质
(2)SiO2广泛存在自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。写出工业上用石英制备粗硅的化学反应方程式
(3)铝是一种重要金属:铝与NaOH溶液反应的离子方程式为:
(4)将10.7g 氯化铵固体与足量消石灰混合加热使之充分反应。生成气体在标准状况下的体积是 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com