
| A. | 分子中含有碳碳双键 | |
| B. | 易被酸性KMnO4溶液氧化 | |
| C. | 与溴水发生加成反应而使溴水褪色 | |
| D. | 在一定条件下可与浓硝酸和浓硫酸的混合酸反应生成硝基苯 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ | ④ |
| 物质 | AlF3 | AlCl3 | BCl3 | NCl3 |
| 熔点/℃ | 1291 | 160 | -107 | -40 |
| A. | BCl3、NCl3分子中各原子最外层都满足8电子稳定结构 | |
| B. | NCl3中心原子价层电子对数比BCl3中心原子价层电子对数多 | |
| C. | AlF3、AlCl3都是强电解质,但晶体类型不同 | |
| D. | BCl3为平面正三角形分子,故它是由极性键构成的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;指出分子中化学键是共价键(填‘离子键’或‘共价键’).
;指出分子中化学键是共价键(填‘离子键’或‘共价键’).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).
某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
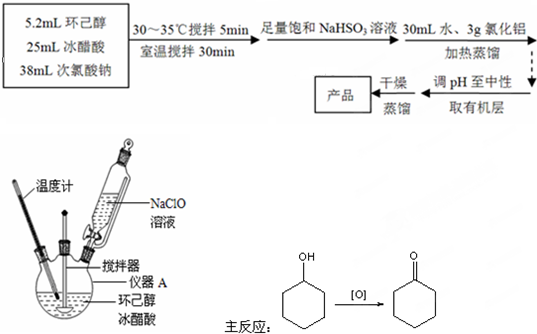
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com