
氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2(g)+1/2O2(g)====H2O(l) ΔH=-285.8 kJ·mol-1
CO(g)+1/2O2(g)====CO2(g) ΔH=-283.0 kJ·mol-1
C8H18(l)+25/2O2(g)====8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是( )
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| n |
| 3 |
| n |
| 3 |
| V/s | 0 | 50 | 100 |
| c(N2O3)/mol?L-1 | 5.00 | 3.52 | 2.48 |
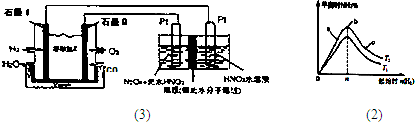
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
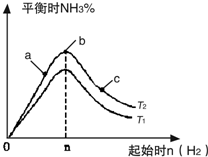 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:| n |
| 3 |
| n |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com