
 Si3N4(s) + 12HCl(g) ��H<0
Si3N4(s) + 12HCl(g) ��H<0 Si3N4(s) + 12HCl(g)
Si3N4(s) + 12HCl(g)


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
| ʵ�� ��� | �������� /g | ���� ״̬ | c(H2SO4) /mol��L��1 | V(H2SO4) /mL | ��Һ�¶�/�� | ������ʧ ��ʱ��/s | |
| ��Ӧǰ | ��Ӧ�� | ||||||
| 1 | 0.10 | ��ĩ | 0.5 | 50 | 20 | 35 | 50 |
| 2 | 0.10 | ˿ | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | ��ĩ | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | ˿ | 1.0 | 50 | 20 | 35 | 125 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ʵ���� | T/K | ����ʯ��� | HNO3Ũ��/mol��L��1 | ʵ��Ŀ�� |
| �� | 298 | �ֿ��� | 2.00 | (��)ʵ��ٺ͢�̽��HNO3Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�죻 (��)ʵ��ٺͣߣ�̽���¶ȶԸ÷�Ӧ���ʵ�Ӱ�죻 (��)ʵ��ٺͣߣ�̽������ʯ���(�֡�ϸ)�Ը÷�Ӧ���ʵ�Ӱ�졣 |
| �� | | | | |
| �� | | �ֿ��� | | |
| �� | | | |
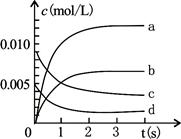
 2NO2(g)������Ӧ���ȡ����n(NO)��ʱ��ı仯���±�����ش�
2NO2(g)������Ӧ���ȡ����n(NO)��ʱ��ı仯���±�����ش�| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��40s | B��15s | C��30s | D��20s |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����п��ϡ������Һ | B����п+ϡ���� |
| C����п��������ͭ����ϡ������Һ | D����п��������ͭ����������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
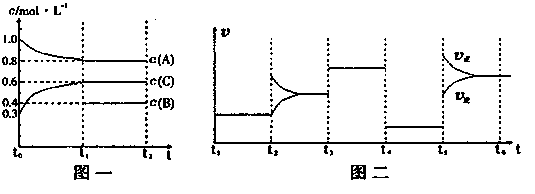
| t1��t2 | t2��t3 | t3��t4 | t4��t5 | t5��t6 |
| K1 | K2 | K3 | K4 | K5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2CO(g)��Ӧ�п�ʹ��Ӧ��������Ĵ�ʩ�ǡ�( )
2CO(g)��Ӧ�п�ʹ��Ӧ��������Ĵ�ʩ�ǡ�( )| A���٢ۢݡ��� | B���ڢܢ� | C���٢ۢޡ��� | D���ۢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢ۢ� | B���ڢܢ� | C���ڢۢ� | D���٢ݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Ӧ��Ũ�ȣ����������ӵİٷ������Ӷ�ʹ��Ч��ײ�������� |
| B��������μӵķ�Ӧ��������ѹǿ�����������ӵİٷ������Ӷ�ʹ��Ӧ�������� |
| C�������¶���ʹ��Ӧ�����������Ҫԭ���Ǽ�С�˷�Ӧ������л���ӵİٷ��� |
| D������������λ����ڻ���ӵİٷ������Ӷ���ǧ��������Ӧ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com