
| A、符合该离子方程式的化学方程式可以是:HClO+HCl=Cl2↑+H2O |
| B、在无色碱性溶液中:ClO、Cl-、Al3+、Na+能大量共存 |
| C、标准状况下,每生成1.12LCl2,转移0.05NA电子 |
| D、洁厕灵(主要成分是盐酸)和84消毒液(主要成分是次氯酸钠)混合使用效果更好 |


科目:高中化学 来源: 题型:
| A、Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 |
| B、反应①中,NaClO是氧化剂 |
| C、反应①为氧化还原反应,反应②为复分解反应 |
| D、若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生活中钢铁制品生锈主要是由于吸氧腐蚀所致 |
| B、石油的裂化、裂解和煤的干馏都属于化学变化 |
| C、天然纤维、人造纤维、合成纤维组成元素相同 |
| D、工业废水中的Cu2+、Hg2+等重金属阳离子可以通过加入FeS除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na、Mg、Al原子的最外层电子数依次减少 |
| B、C、N、O的原子半径依次减小 |
| C、Si、P、S元素的最高正化合价依次降低 |
| D、Li、Na、K的金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
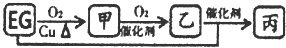 (无机反应物、生成物均已略去):
(无机反应物、生成物均已略去):| Br2(CCl4) |
| NaOH/H2O |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
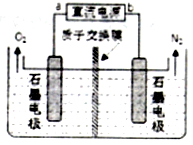
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C5H12有四种同分异构体; |
| B、C2H6与C5H10一定是同系物; |
| C、标准状况下,1mol的己烷约为22.4L |
| D、CH3CH(CH3)CH2CH2C(CH3)3的名称;为2,2,5-三甲基己烷. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com