
| A. | 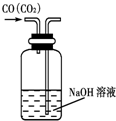 除去CO气体中的CO2气体 | B. | 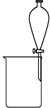 分 分离碘酒中的碘和酒精 | ||
| C. | 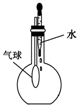 验证NH3的溶解性 | D. | 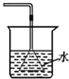 吸收HCl防倒吸 |
分析 A.除杂时导管应长进短出;
B.碘和酒精不分层;
C.挤压胶头滴管,气球变大;
D.防止倒吸,可以在导管中连接体积较大的容器,但装置中连接的漏斗深入吸收液中.
解答 解:A.除杂时导管应长进短出,图中试剂合理,但气体的进入方向不合理,故A错误;
B.碘和酒精不分层,不能利用分液分离,应利用蒸馏法,故B错误;
C.挤压胶头滴管,气球变大,则烧瓶中气压减小,可说明氨气极易溶于水,故C正确;
D.氯化氢极易溶于水,连接的漏斗深入吸收液中,这样不能防止倒吸,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、除杂及性质的比较等,侧重物质的性质及实验技能的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L N2和NH3混合气体中原子间共有3NA个共用电子对 | |
| B. | 3.0 g甲醛HCHO和乙酸混合物中共含碳原子数为0.1NA | |
| C. | 25℃时pH=1的醋酸溶液中含有H+的数目为0.1NA | |
| D. | 标准状况下,2.24 L CH2Cl2含有的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
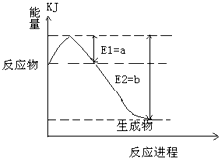 合成氨工业对国民经济和社会发展具有重要意义
合成氨工业对国民经济和社会发展具有重要意义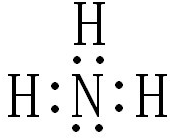
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在国民经济中占有重要地位,具有广泛的用途.
氨在国民经济中占有重要地位,具有广泛的用途. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 前三种均有可能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
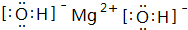 (写电子式).
(写电子式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NH4HCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/LHCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )>c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com