
 、
、 ;
;  ;
;  ,
, 、
、 ;
; ;
; ;
; ;
;
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
 根据电化学知识回答下列问题.
根据电化学知识回答下列问题.| 通电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用水鉴别乙醇、甲苯和溴苯 |
| B、用燃烧法鉴别乙醇、苯和四氯化碳 |
| C、用酸性高锰酸钾溶液鉴别苯、环已烯和环己烷 |
| D、用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
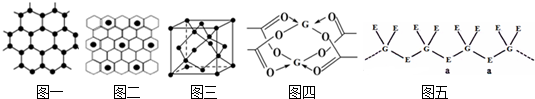
 ”表示),原子分布如图二所示,该物质的化学式为
”表示),原子分布如图二所示,该物质的化学式为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| Y | ||
| Z |
| A、X最外层电子数为2,处在ⅡA族 |
| B、Y的单质与氢气化合很容易 |
| C、Y的最高正价为+7,最低负价为-1 |
| D、Z是活泼的金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有X、Y、Z三种元素,已知X、Y是元素周期表前20号元素,且X的原子序数比Y大4,元素Z形成的金属单质在日常生活中应用最广泛.请回答:
有X、Y、Z三种元素,已知X、Y是元素周期表前20号元素,且X的原子序数比Y大4,元素Z形成的金属单质在日常生活中应用最广泛.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com