
| A. | 氢气 | B. | 碳水化合物 | C. | 碳氢化合物 | D. | 醇类 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 电子云示意图中的小黑点表示原子核最外层的电子 | |
| B. | 某元素有多种同位素,天然存在的该元素其中一种同位素的丰度为75%,则100 g天然存在的该元素中,此同位素的质量为75 g | |
| C. | 核外电子的运动状态是由该电子的电子层、电子亚层、电子云的伸展方向和电子自旋方向共同决定的 | |
| D. | 电子离核越远能量越高,所以N层电子的能量一定高于M层电子的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:c(CH3COOH)+c(CH3COO-)═0.2 mol•L-1 | |
| B. | 0.1 mol•L-1 NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| C. | 0.2 mol•L-1 HCl溶液与等体积0.1 mol•L-1 NaOH溶液混合后,溶液的pH=1 | |
| D. | 0.1 mol•L-1氨水中滴入0.1 mol•L-1盐酸至溶液呈中性时:c(NH4+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl、NaCl | B. | KCl、NaCl、Na2SO4 | ||
| C. | NaCl、Na2SO4、K2SO4 | D. | KCl、Na2SO4、K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
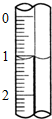 现使用酸碱中和滴定法测定市售白醋的浓度.
现使用酸碱中和滴定法测定市售白醋的浓度.次数 数据(mL) | 1 | 2 | 3 |
| V(样品) | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 14.95 | 16.05 | 15.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃 | B. | 闻气味 | ||
| C. | 湿润的淀粉碘化钾试纸 | D. | 干燥pH试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该分子可能是天然蛋白质水解的产物 | |
| B. | 该分子核磁共振氢谱图可能有两个吸收峰,且面积之比为1:6 | |
| C. | 该分子只有2种同分异构体 | |
| D. | 分子中可能含有个一个羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com