
分析 根据n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=cV计算相关物理量,以此解答.
解答 解:①n(HCl)=$\frac{8.96L}{22.4L/mol}$=0.4mol,答:物质的量为0.4mol;
②N(HCl)=0.4mol×6.02×1023/mol=2.408×1023,答:气体所含的分子数目为2.408×1023;
③mHCl)=0.4mol×36.5g/mol=14.6,答:气体的质量为14.6g;
④c=$\frac{0.4mol}{0.1L}$=4mol/L,答:溶液的物质的量浓度为4mol.L-1;
⑤c=$\frac{0.4mol}{0.2L}$=2mol/L,答:稀释后溶液的物质的量浓度为2mol.L-1.
点评 本题多角度考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的理解以及运用,难度不大.


科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:选择题
已知S、SO2、SO3三种物质的质量比为2:4:5,它们的物质的量之比为
A.10:5:4 B.5:4:2 C.2:4:5 D.1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SO3+H2O═H2SO4 | ||
| C. | 2F2+2H2O═4HF+O2↑ | D. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4L H2含有的原子数为NA | |
| B. | 等质量的O2和O3中所含的氧原子数相同 | |
| C. | 常温常压下,14g N2含有电子数为7NA | |
| D. | 等质量的CO与CO2中所含碳原子数之比为7﹕11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
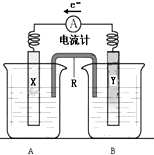 如图是铜锌原电池装置.其电池的总反应是:
如图是铜锌原电池装置.其电池的总反应是:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com