
【题目】按要求回答下列问题:
(1)在25℃、101kPa下,1gCH3OH(l)燃烧生成CO2(g)和H2O(l)时放热22.68kJ。则CH3OH燃烧的热化学方程式为_________________________。
(2)若以(1)中反应原理设计成甲醇燃料电池,电解质溶液为20%~30%的 KOH溶液,则该燃料电池的负极电极反应式为_________________________。
(3)将pH=3的CH3COOH溶液稀释100倍后,溶液的pH范围是____________;将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,溶液显____性(填“酸”、“碱”或“中”)
(4)某温度下,反应2NH3(g)![]() N2(g)+3H2(g)于恒容密闭容器中达到平衡状态。若某时刻向该容器内通入一定量氨气,则化学平衡________移动(填“正向”、“逆向”或“不”)。若某时刻容器内所有物质的浓度均增加为原来的2倍,则化学平衡________移动(填“正向”、“逆向”或“不”)。
N2(g)+3H2(g)于恒容密闭容器中达到平衡状态。若某时刻向该容器内通入一定量氨气,则化学平衡________移动(填“正向”、“逆向”或“不”)。若某时刻容器内所有物质的浓度均增加为原来的2倍,则化学平衡________移动(填“正向”、“逆向”或“不”)。
【答案】 2CH3OH (l)+3O2(g)=2CO2(g)+ 4H2O(1) ΔH=-1451.52kJ/mol CH3OH-6e-+8OH-= CO32-+6H2O 3 酸 正向 逆向
【解析】(1)CH3OH(l)燃烧的化学方程式为:2CH3OH+3O2=2CO2+4H2O,在25℃、101kPa下,1gCH3OH(l)燃烧生成CO2(g)和H2O(l)时放热22.68kJ,所以该条件下2molCH3OH(质量为64g)燃烧生成CO2(g)和H2O(l)时放热22.68kJ×64=1451.52kJ,故CH3OH燃烧的热化学方程式为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1451.52kJ/mol。
(2)甲醇燃料电池,甲醇在负极失电子发生氧化反应,碱性电解质溶液中,OH-会参与负极反应,生成CO32-和H2O,负极电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O。
(3)pH=3的CH3COOH溶液氢离子浓度为10-3mol/L,醋酸是弱电解质,在水溶液中存在电离平衡,加水稀释促进醋酸电离,所以将pH=3的CH3COOH溶液稀释100倍后,氢离子浓度大于10-5mol/L,小于10-3mol/L,所以溶液的pH范围是:3<pH<5;常温下pH=3的CH3COOH溶液的物质的量浓度远大于10-3mol/L,pH=11的NaOH溶液的物质的量浓度等于10-3mol/L,二者等体积混合反应后,CH3COOH剩余很多,则溶液显酸性。
(4)恒温恒容条件下,通入氨气,增大了反应物的浓度,化学平衡正向移动;若某时刻容器内所有物质的浓度均增加为原来的2倍,浓度商Q1=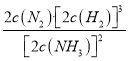 =
=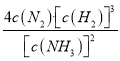 ,因为原平衡浓度商Q=
,因为原平衡浓度商Q=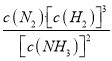 =K,所以改变的条件使浓度商Q1>K,则化学平衡逆向移动。
=K,所以改变的条件使浓度商Q1>K,则化学平衡逆向移动。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】在一个2L的容器内充入6.0mol某气态反应物,经过3s后,它的浓度变成1.2mol/L,在3s内用该反应物浓度的变化表示的反应速率为
A.0.6mol·L—1·s—1 B.0.8mol·L—1·s—1
C.0.4mol·L—1·s—1 D.2.4mol·L—1·s—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:锂离子电池的总反应为:LixC+Li1-xCoO2![]() C+LiCoO2锂硫电池的总反应为:2Li+S
C+LiCoO2锂硫电池的总反应为:2Li+S![]() Li2S。有关上述两种电池说法正确的是
Li2S。有关上述两种电池说法正确的是
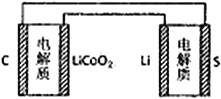
A. 锂离子电池放电时,Li+向负极迁移 B. 锂硫电池充电时,锂电极发生还原反应
C. 理论上两种电池的比能量相同 D. 右图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠保存不当容易变质,某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取10.0g样品,并设计用如图装置来测定过氧化钠的质量分数。

上图中的E和F构成量气装置,用来测定O2的体积。
(1)写出以下装置发生反应的化学方程式:
装置A:___________________________。
装置B:___________________________。
装置C:____________________________。
(2)NaOH溶液的作用是_________________________。
(3)为准确读出氧气的体积需以下操作,正确的顺序为_________。
A.调整量筒高度,使广口瓶E与量筒F内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
读出量筒内水的体积后,折算成标准状况氧气的体积为1.12L,则样品中过氧化钠的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同主族常见的三种元素 X、Y、Z,它们最高价氧化物对应水化物的酸性强弱顺序为:HXO4<HYO4<HZO4 , 下列判断不正确的是( )
A.Y 单质可以在海水中提取
B.单质氧化性:Y>Z
C.气态氢化物稳定性:HX<HZ
D.离子半径:X﹣>Y﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二烯烃C5H8在工业生产中可用于生产生物降解塑料PHB (![]() ),其转化关系如下:
),其转化关系如下:
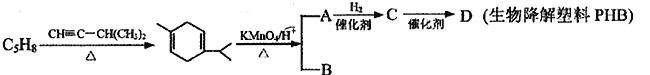
已知:①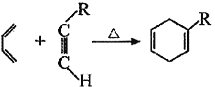
②![]()
③同一个碳原子上不能同时连接两个碳碳双键
请回答:
(1)用系统命名法给二烯烃C5H8命名为__________________,写出该二烯烃的高聚物的反式结构_____________________。
(2)A→C的反应类型为_____________________。
(3)B的结构简式为__________________,所含官能团的名称为_____________________。
(4)C→D的化学反应方程式为____________________________________。
(5)写出符合下列条件的A 的同分异构体的结构简式_____________________。
①与新制的Cu(OH)2发生反应,生成砖红色沉淀;
②与NaHCO3溶液反应产生CO2气体;
③无支链。
(6)参考题中信息,设计由![]() 和H3C-C
和H3C-C![]() C-CH3为主要有机原料合成
C-CH3为主要有机原料合成![]() 的路线流程图(无机试剂任选)_______,合成路线流程图示例如下:
的路线流程图(无机试剂任选)_______,合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: CH3COOH 的酸性强于H2CO3。
(1)请写出H2CO3的电离方程式_____________________________。
(2)请写出CH3COONa 的水解离子方程式_____________________________。
(3)浓度均为0.1mol/L的CH3COONa 溶液和Na2CO3溶液,pH 前者_______后者(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在250mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。取此溶液20mL,用水稀释至100 mL,稀释后该硫酸盐的物质的量浓度为
A.2 mol·L﹣1 B.0.4 mol·L﹣1 C.0.8 mol·L﹣1 D.1.2mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A. 标准状况下,22.4L H2含有的原子数为NA B. 等质量的O2和O3中所含的氧原子数相等
C. 常温常压下,14g N2含有原子数为2NA D. 28g CO与22.4L CO2所含的碳原子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com