
| 气体 | 所用试剂 | 干燥剂 | 装置(可加热) | |
| A | O2 | 氯酸钾和二氧化锰 | 无水氯化钙 | 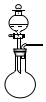 |
| B | NH3 | 浓氨水和生石灰 | 碱石灰 | |
| C | H2 | 稀硝酸和锌粒 | 浓硫酸 | |
| D | SO2 | 浓盐酸和亚硫酸钠 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:多选题
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率/% | 80 | a1 | a2 | a3 | |
| A. | 该温度下,该反应的平衡常数K为400 | |
| B. | SO2的平衡转化率:a1>a2=a3 | |
| C. | 达到平衡时,容器丁中的正反应速率比容器丙中的大 | |
| D. | 达到平衡时,容器丙中c( SO3)大于容器甲中c( SO3)的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | Q | ||
| X | Y |
| A. | 简单离子半径:X<Q | B. | 气态氢化物的稳定性:Y>Q | ||
| C. | X的族序数大于周期数 | D. | Y氧化物对应水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、SO42-,通氨气 | B. | Na+、HCO3-,通氯气 | ||
| C. | Fe2+、NO3-,通氯化氢 | D. | Ca2+、Br-,通二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>W>X | |
| B. | 气态氢化物的热稳定性:X>W | |
| C. | 工业上常用电解对应氯化物的方法制备单质 Z | |
| D. | Y 的最高价氧化物对应的水化物可溶于氯化铵溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用H2O2酸性溶液,将海带灰中的I-转变为I2:H2O2+2I-═I2+2OH- | |
| B. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 工业电解熔融氯化钠制金属钠:2Na++2Cl-$?_{熔融}^{电解}$2Na+Cl2↑ | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2═Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 根据实验现象可以判断电解时阳极的电极反应式为:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
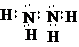 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com