
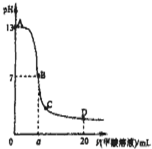
 向15mL 0.1mol?L-1KOH溶液中逐滴加入0.2mol?L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确的是( )
向15mL 0.1mol?L-1KOH溶液中逐滴加入0.2mol?L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确的是( )| A、在A、B间任意一点c(K+)>c(HCOO-)>c(OH-)>c(H+) |
| B、在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5 |
| C、在C点:c(HCOO-)>c(K+)>c(OH-)>c(H+) |
| D、在D点:c(HCOO-)+c(HCOOH)>2c(K+) |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
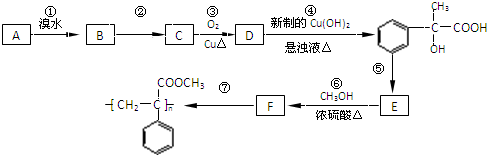
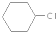 为原料合成重要的化工产品
为原料合成重要的化工产品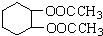 .合成路线流程图示例如下:
.合成路线流程图示例如下: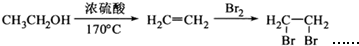 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、转移液体时,玻璃棒应紧靠容量瓶口 |
| B、容量瓶上标有温度、浓度、容积和压强 |
| C、将所需的6.0g氢氧化钠固体倒入到容量瓶中溶解 |
| D、定容时若俯视刻度线观察液面,会使所配制的NaOH 溶液的浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)+c(Na+)=c(HB-)+c(B2-)+c(OH-) |
| B、c(Na+)=0.1 moL/L≥c(B2-) |
| C、c(H+)×c(OH-)=1×10-14 |
| D、溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应过程中,若增大压强能提高SiCl4的转化率 |
| B、若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C、当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应 |
| D、反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
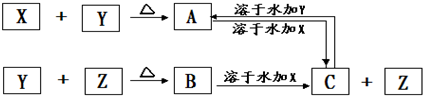
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com