
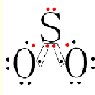 .
. 分析 A原子最外层p亚层的电子数等于次外层的电子数总数,p亚层电子数不超过6,则A的核外电子排布为1s22s22p2,故A为碳元素;A、B、C属于同一周期,即位于第二周期,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,故B为O元素,B元素可分别与A、C、D、E生成RB2型化合物,则C为N元素,可形成NO2化合物;在DB2中D与B的质量比为7:8,则有M(D):2M(O)=7:8,则M(D)=28,故D为Si元素;在EB2中E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素,据此解答.
解答 解:(1)A原子最外层p亚层的电子数等于次外层的电子数总数,p亚层电子数不超过6,则A的核外电子排布为1s22s22p2,故A为碳元素;A、B、C属于同一周期,即位于第二周期,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,故B为O元素,B元素可分别与A、C、D、E生成RB2型化合物,则C为N元素,可形成NO2化合物;在DB2中D与B的质量比为7:8,则有M(D):2M(O)=7:8,则M(D)=28,故D为Si元素;在EB2中E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素,
故答案为:C;O;N;Si;S;
(2)同周期自左而右电负性增大,同主族自上而下电负性减小,S的电负性小于氮的,电负性越大,非金属性越强,因为S比C非金属性强,S的电负性大于碳的,则电负性O>N>S>C>Si,
故答案为:O>N>S>C>Si;
(3)E和B形成化合物SO2的电子式: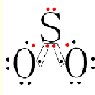 ,故答案为:
,故答案为: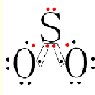 .
.
点评 本题是对物质结构的考查,涉及核外电子排布、电负性、电子式等,题目中的电负性比较、电子式书写在中学中基本不接触,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑧⑨ | B. | ①②③⑥⑦⑨ | C. | ①②③④⑥⑦⑨⑩ | D. | ①②③④⑥⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 苯(甲苯) | 酸性高锰酸钾溶液 NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
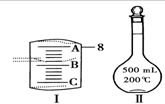 实验室要用Na2CO3•10H2O晶体配制500mLO.1mol•L-1Na2CO3溶液,回答下列问题:
实验室要用Na2CO3•10H2O晶体配制500mLO.1mol•L-1Na2CO3溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
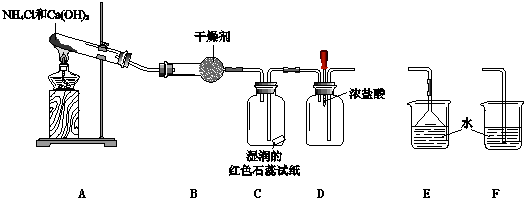
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 有关问题 |
| (1)计算所需浓硫酸的体积 | 需取浓硫酸(1.7)mL |
| (2)量 取浓硫酸 | 需要用到的主要仪器是:5mL量筒 |
| (3)将 浓硫酸沿着玻璃棒缓缓注入盛有水的烧杯中并搅拌 | 该操作要做到胆大心细,杜绝事故发生 |
| (4)待溶液冷却至室温,将烧杯中溶液转移至250mL容量瓶中 | 要注意把洗涤液一并转移至容量瓶中 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2cm处后的正确操作是:改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切 |
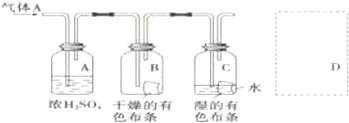
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z | |
| B. | 非金属性:X>Y>Z | |
| C. | 阴离子的还原性按X、Y、Z的顺序由强到弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com