
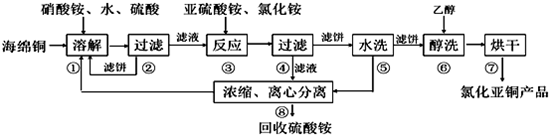
分析 酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,步骤②、④、⑤、⑧都要进行固液分离,根据混合的水溶性进行分离,没有发生化学变化,可用离心机以及框式压滤机,以得到滤饼,氯化亚铜与氯化铁发生Fe3++CuCl═Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,结合关系式解答该题.
解答 解:酸性条件下硝酸根具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,烘干得到氯化亚铜,
(1)由于酸性条件下硝酸根离子具有氧化性,可氧化Cu生成CuSO4或Cu2+,溶解温度应控制在60-70℃,原因是温度低溶解速度慢,温度过高铵盐分解,
故答案为:CuSO4或Cu2+;温度低溶解速度慢,温度过高铵盐分解;
(2)铜离子与亚硫酸铵发生氧化还原反应生成CuCl,反应为2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,
故答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+;
(3)由流程可知,经酸洗、水洗后得到硫酸铵,则应加入硫酸,为防止CuCl溶解,不能加入硝酸等氧化性酸,也不能加入盐酸,防止引入新杂质,
故答案为:硫酸;
(4)步骤⑥为醇洗,因乙醇沸点低,易挥发,则用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,
故答案为:醇洗有利于加快去除CuCl表面水分防止其水解氧化;
(5)步骤②、④、⑤、⑧都要进行固液分离,根据混合的水溶性进行分离,没有发生化学变化,可用离心机以及框式压滤机,以得到滤饼,
故答案为:BD;
(6)氯化亚铜与氯化铁发生Fe3++CuCl═Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
反应的关系式为6CuCl~6Fe2+~Cr2O72-,
6 1
n ab×10-3mol
n=6ab×10-3mol,
m(CuCl)=99.5g/mol×6ab×10-3mol=0.597abg,
则样品中CuCl的质量分数为$\frac{0.597ab}{m}$,
故答案为:$\frac{0.597ab}{m}$.
点评 本题为考查学生阅读获取信息的能力、常用化学用语、氧化还原滴定的应用等,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握物质的性质以及反应流程,难度中等,注意(6)中利用关系式的计算.


科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定小于92.4kJ | B. | 一定等于92.4kJ | C. | 可能大于92.4kJ | D. | 都有可能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
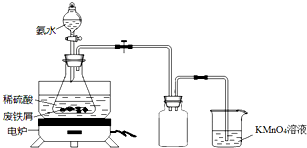 某实验小组用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体[K3Fe(C2O4)3•3H2O]并测定其组成.
某实验小组用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体[K3Fe(C2O4)3•3H2O]并测定其组成.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
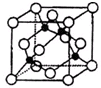 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.请回答下列问题:
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>HI | B. | 沸点:H2O<H2S<H2Se | ||
| C. | 酸性:HClO4>H2SO4. | D. | 离子半径:N3->O2->F- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠是焙制糕点的发酵粉的一种成分 | |
| B. | CO、NO、NO2都是大气污染物,在空气中都能稳定存在 | |
| C. | 光导纤维和玻璃都是硅酸盐产品 | |
| D. | 明矾能作净水剂,因为它能与水反应生成强氧化性的氢氧化铝胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com