
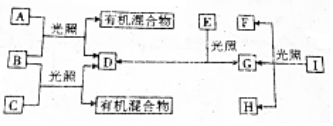
 ,有机物C的结构简式为
,有机物C的结构简式为 ,其苯环上的二氯代物共有6种.
,其苯环上的二氯代物共有6种.分析 A是含氢量最高的烃即CH4,B是一种黄绿色气体即Cl2,所以CH4与Cl2光照反应生成有机混合物和D,则D为HCl;芳香烃C的分子式为C7H8,C也能与Cl2光照反应生成有机混合物和D,所以C的结构简式为 ;物质E具有漂白性,光照生成D(HCl)和G,所以E为HClO,G为O2;
;物质E具有漂白性,光照生成D(HCl)和G,所以E为HClO,G为O2;
I是一种易挥发的强氧化性酸,光照生成G(O2)、F和H,则为硝酸见光分解生成二氧化氮、氧气和水,所以I为HNO3,F和H为二氧化氮和水;据此分析解答.
解答 解:(1)根据以上分析,B和E的化学式分别为Cl2、HClO;故答案为:Cl2;HClO;
(2)A是含氢量最高的烃即CH4,碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为 ;C的结构简式为
;C的结构简式为 ,
, 中,当2个氯都取代苯环上的H时,采用定一议二的方法,当其中一个氯在甲基的邻位时,另外一个氯还有4种位置,故此二氯代物有4种结构;当其中一个氯在甲基的间位时,另一个氯有2种位置,当其中一个氯在甲基的对位时,另一个氯没有位置,所以其苯环上的二氯代物共有4+2=6种,故答案为:
中,当2个氯都取代苯环上的H时,采用定一议二的方法,当其中一个氯在甲基的邻位时,另外一个氯还有4种位置,故此二氯代物有4种结构;当其中一个氯在甲基的间位时,另一个氯有2种位置,当其中一个氯在甲基的对位时,另一个氯没有位置,所以其苯环上的二氯代物共有4+2=6种,故答案为: ;
; ;6;
;6;
(3)I为硝酸见光分解生成二氧化氮、氧气和水,反应方程式为:4HNO3$\frac{\underline{\;见光\;}}{\;}$4NO2↑+O2↑+2H2O,故答案为:4HNO3$\frac{\underline{\;见光\;}}{\;}$4NO2↑+O2↑+2H2O.
点评 本题考查无机有机混合推断,为高频考点,涉及物质推断、方程式的书写、二氯代物种类的判断等知识点,明确物质的性质、化学反应原理是解本题关键,注意利用物质特殊性质进行推断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| B. | SO2具有氧化性,可用于漂白纸浆 | |
| C. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| D. | 硅是重要的半导体材料,常用于制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 德国化学家维勒第一次人工合成了尿素,从而揭开了人工合成有机物的序幕 | |
| B. | 中国化学家侯德榜成功发明了侯氏制碱法,打破了外国当时对中国的相关技术封锁 | |
| C. | 英国科学家卢瑟福根据α粒子散射实验提出了“葡萄干面包式”原子结构模型 | |
| D. | 俄国化学家门捷列夫在前人基础上研究提出了元素周期律并列出了第一张元素周期表 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小:Z>Y>X>W | |
| B. | 由W元素形成的单质一定是原子晶体,其熔沸点很高 | |
| C. | W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 | |
| D. | Y、Z所形成的氧化物的水化物的酸性为:Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬脂酸甘油酯在NaOH溶液中水解完全后,加入饱和食盐水,下层析出硬脂酸钠 | |
| B. | 天然高分子化合物淀粉或纤维素最终的水解产物都是葡萄糖 | |
| C. | 鸡蛋清的溶液中加入福尔马林溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该烃是苯的同系物 | |
| B. | 该烃分子中至少有9个碳处于同一平面上 | |
| C. | 该烃分子中的所有原子有可能处于同一平面上 | |
| D. | 该烃的一氯代物最多有四种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com