
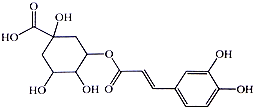
 银翘的金银花与连翘配成的中成药,具有辛凉解表,清热解毒,用于流行感冒引起的发热、咳嗽、口干、咽喉肿痛.其中的一种具有较广泛的杀菌作用的有效成分--绿原酸,结构简式见图.下列描述错误的是( )
银翘的金银花与连翘配成的中成药,具有辛凉解表,清热解毒,用于流行感冒引起的发热、咳嗽、口干、咽喉肿痛.其中的一种具有较广泛的杀菌作用的有效成分--绿原酸,结构简式见图.下列描述错误的是( )| A. | 绿原酸有可能通过酯化反应人工合成 | |
| B. | 1mol绿原酸能与4molBr2发生加成反应 | |
| C. | 1mol绿原酸能与6molNa发生置换反应 | |
| D. | 绿原酸能与NaHCO3溶液发生反应放出CO2 |
分析 该有机物含有酚羟基,可发生取代、氧化反应,含有羧基,具有酸性可发生中和、取代反应,含有酯基,可发生水解反应,含有羟基,可发生取代、消去、氧化反应,含有碳碳双键,可发生加成、氧化反应,以此解答该题.
解答 解:A、该有机物含有酯基,有可能通过酯化反应人工合成,故A正确;
B、该有机物含有1mol碳碳双键,能够与1mol溴发生加成反应,故B错误;
C、该有机物含有5mol羟基,1mol羧基,1mol绿原酸能与6molNa发生置换反应,故C正确;
D、绿原酸含有羧基,能够与NaHCO3溶液发生反应放出CO2,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物官能团与性质的关系为解答的关键,侧重酚、酯性质的考查,选项CD为解答的难点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: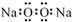 | |
| B. | “玉兔”号月球车上使用的质子数94,中子数144的钚原子:${\;}_{94}^{144}$Pu | |
| C. | CH4的球棍模型: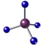 | |
| D. | Na的原子结构示意图: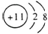 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是学习研究其它化学知识的载体.
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是学习研究其它化学知识的载体.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当一个可逆反应达到平衡状态时,这个反应的正、逆反应速率相等 | |
| B. | 化学平衡状态是一种静止状态,因为反应物和生成物的浓度已经不再改变 | |
| C. | 当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的最大限度 | |
| D. | 化学反应的限度不可以通过改变条件而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 300 | 500 | 830 |
| 平衡常数K | 12 | 9 | 1 |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钠暴露在空气中,表面变暗,生成白色固体氧化钠 | |
| B. | 用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼的白光,放出大量的热,产生白色固体 | |
| C. | 铜的化学性质很稳定,铜在任何条件下都不会生锈 | |
| D. | 用坩埚钳夹住铁丝在酒精灯上加热红热,迅速伸进氧气瓶中,剧烈燃烧火星四射,放出大量的热,生成红棕色的固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | Fe(OH)3溶液氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 按图装置进行电解实验(A、B、C、D均为铂电极),供选择的四组电解液列在下表中,要满足的条件是:(1)通电一段时间后甲池和乙池的pH值都下降,(2)电极C、A所得电解产物的物质的量之比为2:1,甲、乙两电池中电解液组号数是( )
按图装置进行电解实验(A、B、C、D均为铂电极),供选择的四组电解液列在下表中,要满足的条件是:(1)通电一段时间后甲池和乙池的pH值都下降,(2)电极C、A所得电解产物的物质的量之比为2:1,甲、乙两电池中电解液组号数是( )| 组号 | 甲 | 乙 |
| 1 | NaCl | AgNO3 |
| 2 | AgNO3 | CuCl2 |
| 3 | H2SO4 | AgNO3 |
| 4 | CuSO4 | HNO3 |
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com