
| A、反应后溶液中离子浓度大小关系为:c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| B、发生反应生成的AgI沉淀多于AgCl沉淀 |
| C、在水中AgCl的溶解度比AgI的溶解度大 |
| D、若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
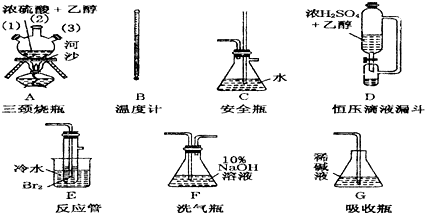
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲和丁的最简式相同 |
| B、丁的分子量是丙的两倍 |
| C、甲既可是饱和一元醛,又可是饱和一元酮 |
| D、甲的分子中一定具有甲基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若要除去苯中的苯酚,加入NaOH溶液充分振荡,然后分液 |
| B、向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体现象,说明溶液中的反应生成了NO2 |
| C、向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成,说明淀粉没有水解成葡萄糖 |
| D、相同温度下,取两份等质量的锌粒分别与足量稀硫酸反应,向其中一份中加入几滴CuSO4溶液.加入CuSO4溶液的产生氢气快,最终二者生成氢气的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
B、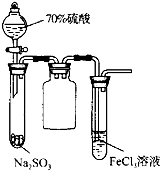 实验试管中出现淡黄色浑浊 |
C、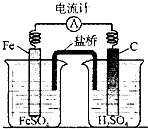 实验中碳棒上有无色气泡产生 |
D、 实验中酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若X、Y都是气态氢化物,且相对分子质量:X>Y,则沸点:X>Y |
| B、若R2-和M+的电子层结构相同,则原子序数:R>M |
| C、若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y强 |
| D、若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质、纤维素、蔗糖、天然橡胶、淀粉都是高分子化合物 |
| B、乙烯和苯都能使溴水褪色,褪色的原因相同 |
| C、淀粉、葡萄糖、脂肪和蛋白质在一定条件下都能发生水解反应 |
| D、米酒变酸的过程涉及了氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com