
��13�֣������Dz��ֶ������еڶ�����������Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼۡ�
| Ԫ�ش��� | �� | �� | �� | �� | �� | �� | �� | �� |
| ԭ�Ӱ뾶��nm�� | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| ��Ҫ���ϼ� | ��1 | ��2 | ��1 | ��3 | ��5�� ��3 | ��7�� ��1 | ��5�� ��3 | ��2 |
�ش��������⣺
1.����Ԫ�����ڱ��е�λ���ǣ����ڡ��壩 ��
2.����8��Ԫ�ص�����������ˮ�����У�������ǿ���� ���ѧʽ����
3.��Ԫ�غ͢�Ԫ���γɻ�����ĵ���ʽ�� ��
4.д���ٺܵ͢�����������Ӧˮ���ﷴӦ�����ӷ���ʽ��
��
5.�ڡ��ܡ��ݡ��ļ����ӵ����Ӱ뾶�ɴ�С��˳���ǣ� �� �� �� ���������ӷ��ţ�
6.�ȽϢݡ�����̬�⻯����ȶ��� �� ���÷���ʽ��ʾ��
7.���������в���ȷ���� ������ĸ����
A���ۡ��ܴ��ڲ�ͬ����
B������ͬ����Ԫ���зǽ�������ǿ
C����Ԫ�����Ԫ�����ߺ˵����֮����8
D��������γɵĻ�����ֻ�������Ӽ�
1.�ڶ����ڵڢ�A��
2.HClO4 3.
4.Al(OH)3+OH-===AlO2-+2H2O
5.P3->Cl->Mg2+>Al3+
6.NH3>PH3
7.ABC
����:����Ԫ�������ɵ�Ӧ�á�����Ԫ�ص���Ҫ���ϼۺ���ԭ�Ӱ뾶�Ĵ�С��֪�١���ֱ�ΪNa��Mg��Li��Al��P��Cl��N��O��
��3���ƺ����γɵĻ�ѧ�������Ӽ�������ʽΪ��
��4�����������������������������ǿ�����������У�����ƫ�����ƺ�ˮ
��5����������Ų���ͬ�����������뾶��ԭ�������ĵ�������С���������Ӱ뾶��С˳��ΪP3->Cl->Mg2+>Al3+��
��6��ͬ����Ԫ�����϶��·ǽ�������������Ӧ�⻯����ȶ�������������NH3>PH3��
��7���λ�ڵڶ����ڣ����ǵ������ڣ�A�������ǵ���A��ͬ�����зǽ�������ǿ���Ƿ���B����ȷ��N��P�ĺ˵����֮����8��C����ȷ��O��Na�γɵĹ��������к��зǼ��Լ������Ӽ���D����ȷ����ѡBCD��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

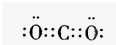
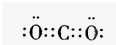
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com