
完成以下实验:
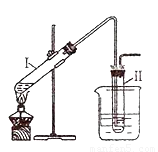
用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验。在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。试回答下列问题:

(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式 _。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有 _ 、 (写出两种有机物的结构简式)。
(3)溴乙烷的沸点较低,易挥发,为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,上图中采取的措施有 、 _。
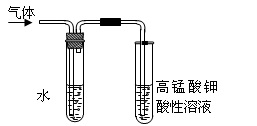
(4)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过下图所示的装置。用下图装置进行实验的目的是 _;下图中右边试管中的现象是 ;水的作用是 。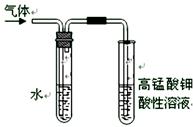
(1)HBr + C2H5OH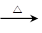 C2H5Br + H2O (2)CH2=CH2 CH3CH2OCH2CH3
C2H5Br + H2O (2)CH2=CH2 CH3CH2OCH2CH3
(3)试管Ⅱ塞上带有导管的塞子并在其中加水;把试管Ⅱ放入盛有冷水的烧杯中;使用长导管等
(4)验证生成的气体是乙烯(或验证溴乙烷与NaOH发生消去反应的产物)
高锰酸钾溶液的紫红色褪去 除去气体中混有的少量乙醇等杂质
【解析】
试题分析:(1)在加热的条件下,乙醇和溴化氢发生取代反应,生成溴乙烷和水,则反应的化学方程式是HBr + C2H5OH C2H5Br + H2O。
C2H5Br + H2O。
(2)由于在浓硫酸的作用下,乙醇也可能发生消去反应生成乙烯,也可能发生分子间的脱水,生成乙醚,结构简式分别是CH2=CH2、CH3CH2OCH2CH3。
(3)由于溴乙烷易挥发,则要使溴乙烷烷冷凝在试管Ⅱ中,减少挥发,正确的方法有试管Ⅱ塞上带有导管的塞子并在其中加水;把试管Ⅱ放入盛有冷水的烧杯中;使用长导管等。
(4)在氢氧化钠的醇溶液中,溴乙烷发生消去反应生成乙烯,乙烯含有碳碳双键,能使酸性高锰酸钾溶液褪色,所以根据装置图可知,实验目的是验证生成的气体是乙烯(或验证溴乙烷与NaOH发生消去反应的产物),而实验现象是高锰酸钾溶液的紫红色褪去。但由于乙醇易挥发,且乙醇也能使酸性高锰酸钾溶液褪色,所以水的作用是除去气体中混有的少量乙醇等杂质,防止干扰乙烯的性质检验。
考点:考查乙醇和溴化氢、溴乙烷的消去反应以及乙烯的性质检验
点评:该题是基础性实验题的考查,该题紧扣教材基础知识,有利于调动学生的学习兴趣,激发学生的学习积极性,有利于培养学生规范严谨的实验设计能力,提升学生的学科素养。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 完成以下实验:①用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验.在试管I中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,冷却.
完成以下实验:①用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验.在试管I中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,冷却.| △ |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
I.下列实验中仪器的下端必须插入反应物液面下的是: 。(填写序号)
① 制备氢气的简易装置中的长颈漏斗;②制备氯气装置中的分液漏斗; ③制备硝基苯时的温度计; ④用乙醇制取乙烯时的温度计; ⑤分馏石油时的温度计。
II.完成以下实验:①用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验。在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。试回答下列问题:
(1)试管I中反应的化学方程式 __________________。
(2)反应结束后,U形管中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_______________(填字母)
A.NaOH溶液 B.H2O C.Na2SO3溶液 D.CCl4
(3)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后__________________(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
(4)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过下图所示的装置。
用上图装置进行实验的目的是 _;上图中右边试管中的现象是 ;水的作用是 。
(5)溴乙烷(C2H5Br)多一个碳的同系物在氢氧化钠的醇溶液中能发生反应,生成的产物为_________________
查看答案和解析>>
科目:高中化学 来源:2010年浙江省温州中学高二上学期期中考试化学卷 题型:填空题
I.下列实验中仪器的下端必须插入反应物液面下的是: 。(填写序号)
①制备氢气的简易装置中的长颈漏斗;②制备氯气装置中的分液漏斗; ③制备硝基苯时的温度计;④用乙醇制取乙烯时的温度计; ⑤分馏石油时的温度计。
II.完成以下实验:①
用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验。在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。试回答下列问题: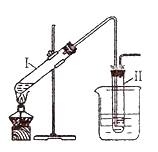
(1)试管I中反应的化学方程式 __________________。
(2)反应结束后,U形管中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_______________(填字母)
| A.NaOH溶液 | B.H2O | C.Na2SO3溶液 | D.CCl4 |
查看答案和解析>>
科目:高中化学 来源:2009—2010学年广州市七区联考高二化学下学期期末监测 题型:实验题
(12分)完成以下实验:①
用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验。在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。试回答下列问题:
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式 _。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有 _ 、 (写出两种有机物的结构简式)。
(3)溴乙烷的沸点较低,易挥发,为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,上图中采取的措施有 、 _。
(4)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过下图所示的装置。用下图装置进行实验的目的是 _;下图中右边试管中的现象是 ;水的作用是 。
查看答案和解析>>
科目:高中化学 来源:2010年浙江省高二上学期期中考试化学卷 题型:填空题
I.下列实验中仪器的下端必须插入反应物液面下的是: 。(填写序号)
① 制备氢气的简易装置中的长颈漏斗; ②制备氯气装置中的分液漏斗; ③制备硝基苯时的温度计; ④用乙醇制取乙烯时的温度计; ⑤分馏石油时的温度计。
II.完成以下实验:①用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验。在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。试回答下列问题:
(1)试管I中反应的化学方程式 __________________。
(2)反应结束后,U形管中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_______________(填字母)
A.NaOH溶液 B.H2O C.Na2SO3溶液 D.CCl4
(3)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后__________________(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
(4)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过下图所示的装置。
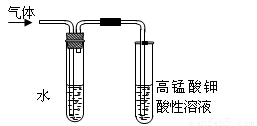
用上图装置进行实验的目的是 _;上图中右边试管中的现象是 ;水的作用是 。
(5)溴乙烷(C2H5Br)多一个碳的同系物在氢氧化钠的醇溶液中能发生反应,生成的产物为_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com