
| A、HNO3 |
| B、Cl2 |
| C、NH4NO3 |
| D、SO2 |


科目:高中化学 来源: 题型:
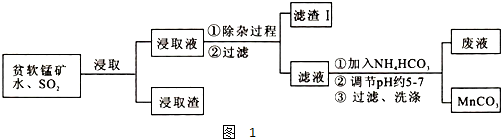
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化铝 | 3.3 | 5.2 |
| 氢氧化亚铁 | 7.6 | 9.6 |
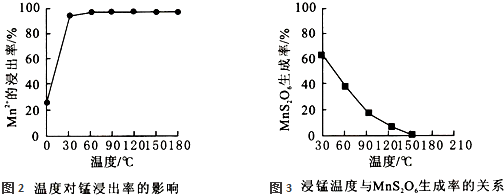
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8 | B、6 | C、4 | D、2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 molH2的质量是1 g |
| B、1 mol HCl的质量是36.5 g?mol-1 |
| C、Cl2的摩尔质量等于它的相对分子质量 |
| D、硫酸根离子的摩尔质量是96 g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
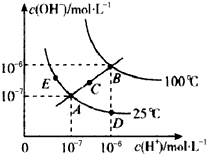
| A、从图中可以看出,水的电离是吸热过程 |
| B、若从A点到D点,可采用:温度不变在水中加入适量的NH4Cl固体 |
| C、在处于C点状态的溶液中:Na+、Al3+、CO32-、Cl-能够大量共存 |
| D、在处于E点状态的CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH+)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 表示碳原子,用
表示碳原子,用 表示氧原子,用
表示氧原子,用 表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题: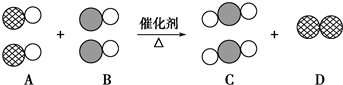
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体 | B、悬浊液 |
| C、溶液 | D、乳浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com