
【题目】已知KMnO4和H2C2O4(草酸)在酸性溶液中会发生氧化还原反应。甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下(实验中所用KMnO4溶液均已酸化)
(1)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率,实验装置如图所示:

实验时仪器中的A溶液一次性加入,A、B的成分见下表:
序号 | A溶液 | B溶液 |
① | 2 mL 0.1 mol·L-1H2C2O4溶液 | 4 mL 0.01 mol·L-1KMnO4溶液 |
② | 2 mL 0.2 mol·L-1H2C2O4溶液 | 4 mL 0.01 mol·L-1KMnO4溶液 |
③ | 2 mL 0.2 mol·L-1H2C2O4溶液 | 4 mL 0.01 mol·L-1KMnO4溶液,少量MnSO4固体(催化剂) |
①盛放A溶液的仪器名称_______,锥形瓶中反应的化学方程式:______
②该实验探究的是_____因素对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是____(填实验序号)。
(2)乙组:通过测定KMnO4溶液褪色所需时间的长短来比较化学反应速率。
取两支试管各加入2 mL 0.1 mol·L-1H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol·L-1KMnO4溶液,将四支试管分成两组(每组各有一支试管盛有H2C2O4溶液和KMnO4溶液),一组放入冷水中,另一组放入热水中,一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究________因素对化学反应速率的影响,但该组同学始终没有看到溶液完全褪色,其原因是______
【答案】分液漏斗 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O 反应物的浓度和催化剂 ③>②>① 温度 酸性高锰酸钾溶液过量
【解析】
利用KMnO4和H2C2O4(草酸)在酸性溶液中会发生氧化还原反应制备二氧化碳,通过测定单位时间内生成CO2气体体积的大小和测定KMnO4溶液褪色所需时间的长短来比较化学反应速率,进而探究外因对化学反应速率的影响。
(1) ①常温下,酸性KMnO4和H2C2O4(草酸)反应生成二氧化碳,盛放H2C2O4溶液的仪器名称为分液漏斗,依据氧化还原反应的规律可知该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O;
②对比实验序号为①②的实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大;对比②③实验可探究催化剂对化学反应速率的影响,③中使用了催化剂,故相同时间内③实验中所得二氧化碳最多,故答案为:反应物的浓度和催化剂;③>②>①;
(2)草酸和高锰酸钾反应的方程式为:2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O,
草酸的物质的量为:0.002 L×0.1 molL1=2×104 mol,
高锰酸钾的物质的量为:0.004 L×0.1molL1=4×104 mol,
由方程式可知,酸性高锰酸钾过量,故没看到溶液完全褪色,故答案为:酸性高锰酸钾溶液过量。


科目:高中化学 来源: 题型:
【题目】分散系存在比较广泛,日常生活中常见的烟、雾、碘酒、食盐水等都是分散系,关于这四种分散系的分散质和分散剂的说法中,正确的是( )
分散系 | 分散质 | 分散剂 | |
A | 烟 | 微小水滴 | 空气 |
B | 雾 | 微小尘埃 | 空气 |
C | 碘酒 | 碘 | 酒精 |
D | 食盐水 | 水 | 氯化钠 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和实验结论均正确的是
实验操作 | 实验结论 | |
A | 先加少量氯水,再滴加KSCN溶液,出现血红色 | 证明某溶液中存在Fe2+ |
B | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向碳酸钙中滴加盐酸,有气泡产生 | 证明氯的非金属性大于碳 |
D | 将MgCl2溶液在氯化氢的气流中蒸发、结晶、过滤 | 制备氯化镁晶体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
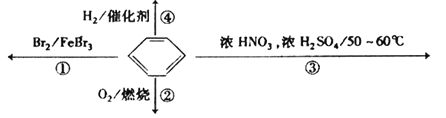
A. 反应![]() 为取代反应,有机产物的密度比水小
为取代反应,有机产物的密度比水小
B. 反应![]() 为取代反应,有机产物是一种烃
为取代反应,有机产物是一种烃
C. 反应![]() 中1mol苯最多与
中1mol苯最多与![]() 发生加成反应,是因为苯分子含有三个碳碳双键
发生加成反应,是因为苯分子含有三个碳碳双键
D. 反应![]() 为氧化反应,反应现象是火焰明亮并带有较多的黑烟
为氧化反应,反应现象是火焰明亮并带有较多的黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的叙述中正确的是( )
A. 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料元素
B. 在过渡元素中可以寻找制备催化剂
C. 在元素周期表的右上角可以寻找制备耐高温和耐腐蚀的元素
D. 在地球上元素的分布和它们在元素周期表中的位置有密切关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N0表示阿伏加德罗常数的值,下列说法正确的是
A. 1g H2所含分子数为N0
B. 2g D2O中所含的质子数为N0
C. 0.5 mol/L Na2SO4溶液中所含Na+ 数为N0
D. 标准状况下,4.48 L CCl4所含原子数为N0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1,则HCN在水溶液中电离的ΔH等于
A. -67.7 kJ·mol-1 B. -43.5 kJ·mol-1 C. +43.5 kJ·mol-1 D. +67.7 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com