
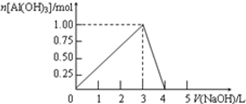
 向0.5L的AlCl3溶液中逐滴加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果正确的是( )
向0.5L的AlCl3溶液中逐滴加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果正确的是( )| A、反应过程中,沉淀最多时的质量为7.8g | B、AlCl3溶液的浓度为2.0 mol?L-1 | C、得到39g沉淀时,消耗的NaOH溶液体积一定为1.5 L | D、当V(NaOH)=4.0 L时,得到的溶液中含Na+、Cl- |
| 1mol |
| 0.5L |
| 1.5mol |
| 1mol/L |


科目:高中化学 来源: 题型:阅读理解
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)运用化学反应原理研究NH3的性质具有重要意义。
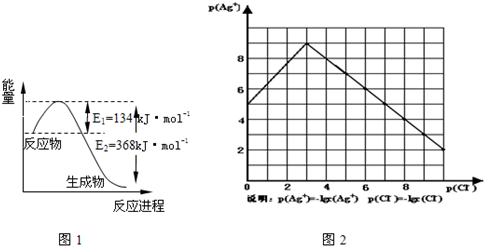
(1)科学家一直致力于“人工固氮”的新方法研究。据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质。在使用催化剂b和不使用催化剂a时,该反应过程和能量的变化关系如图所示。
①写出该反应的化学方程式 。
②a和b相比,二者的平衡常数关系是Ka Kb(填“>”、“=”或“<”)
③升高温度,平衡时NH3的含量 (填“增大”、“不变”或“减小”)
(2)在0.5L的密闭容器中,一定量的N2和H2发生反应:N2(g) + 3H2(g) 2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2) v逆(N2)(填 “>” 、“=” 或“<”)
(3)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
| 浓度mol.L-1 时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
①则2 ~4min内,v(O2)= 。
②在第8min时改变条件,你认为改变的条件可能是 。
(4)常温下,向0.001mol·L-1的AlCl3 溶液中通入NH3直至过量,现象 ,当PH = 时,开始生成沉淀(已知:Ksp[Al(OH)3]= 1.0×10-33)。
查看答案和解析>>
科目:高中化学 来源: 题型:
向体积为0.5L的
AlCl3溶液中逐
滴加入某
浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如右图所示。下列结果正确的是
 A.反应过程中,沉淀最多时的质量为7.8g
A.反应过程中,沉淀最多时的质量为7.8g
B.AlCl3溶液的浓度为2.0mol/L
C.得到39g沉淀时,消耗的NaOH溶液体积
一定为1.5L
D.当NaOH溶液体积为4.0L时,得到的溶液中Na+、Cl-浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如右图所示。下列结果正确的是
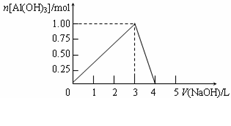 A.反应过程中,沉淀最多时的质量为7.8g
A.反应过程中,沉淀最多时的质量为7.8g
B.AlCl3溶液的浓度为2.0 mol/L
C.得到39g沉淀时,消耗的NaOH溶液体积
一定为1.5 L
D.当V(NaOHaq)=4.0 L时,得到的溶液中
Na+、Cl-浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com