
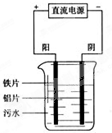
 电浮选凝聚法是工业上采用的一种污水处理方法如图是电解污水装置示意图.
电浮选凝聚法是工业上采用的一种污水处理方法如图是电解污水装置示意图.

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
| A、1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L |
| B、从1L2mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1mol/L |
| C、配制480mL0.5 mol/L的CuSO4溶液,需62.5g胆矾 |
| D、10g98%的硫酸(密度为1.84 g?cm-3)与10 mL18.4 mol?L-1的硫酸的浓度不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
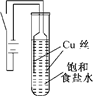 某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸溶液 | 沉淀溶解,有无色气泡产生,最终得到蓝色溶液 |
| ② | 滴入稀硫酸溶液 | 橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜(不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色或橙黄色 | 氯化亚铜 | 白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解过程中有0.02mol电子转移 |
| B、阳极产物只有氯气 |
| C、在标准状况下,阳极产生的气体体积为0.448L |
| D、电解后溶液的pH=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①③④ | B、②③④ |
| C、②③⑤ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、前2 min D的平均反应速率为0.2 mol?L-1?min-1 |
| B、此时,B的平衡转化率是40% |
| C、增大该体系的压强,平衡不移动 |
| D、增加B,平衡向右移动,B的平衡转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com