
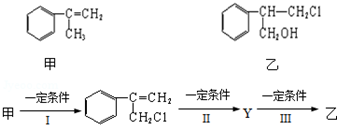
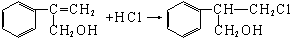 .
.分析 (1)由结构简式可确定含有的官能团;
(2)甲与氯气发生取代反应,侧链中甲基中H原子被氯原子取代生成 ,在氢氧化钠水溶液、加热条件下发生的其反应生成Y,Y为
,在氢氧化钠水溶液、加热条件下发生的其反应生成Y,Y为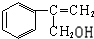 ,
,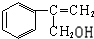 再与HCl发生加成反应生成乙;
再与HCl发生加成反应生成乙;
(3)乙有多种同分异构体中符合:a.苯环上的一氯代物有两种,则有两个不同取代基、且处于对位位置可以满足,b.遇FeCl3溶液显示紫色,含有酚羟基-OH,故另一基团可以是-CH2CH2CH2Cl等.
解答 解:(1)由结构简式可知有机物含有氯原子、羟基,故答案为:氯原子、羟基;
(2)甲与氯气发生取代反应,侧链中甲基中H原子被氯原子取代生成 ,在氢氧化钠水溶液、加热条件下发生的其反应生成Y,Y为
,在氢氧化钠水溶液、加热条件下发生的其反应生成Y,Y为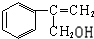 ,
,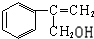 再与HCl发生加成反应生成乙,方程式为:
再与HCl发生加成反应生成乙,方程式为: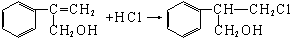 ,
,
故答案为:取代反应;NaOH水溶液、加热;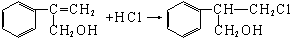 ;
;
(3)乙有多种同分异构体中符合:a.苯环上的一氯代物有两种,则含有两个不同取代基、且处于对位位置可以满足,b.遇FeCl3溶液显示紫色,含有酚羟基-OH,故另一基团可以是-CH2CH2CH2Cl等,故符合条件的同分异构体有: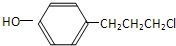 等.则同分异构体取决于-CH2CH2CH2Cl的种类,可为-CH2CH2CH2Cl、-CH2CHClCH3、-CHClCH2CH3、-CCl(CH3)2、-CH(CH3)CH2Cl等,共5种,
等.则同分异构体取决于-CH2CH2CH2Cl的种类,可为-CH2CH2CH2Cl、-CH2CHClCH3、-CHClCH2CH3、-CCl(CH3)2、-CH(CH3)CH2Cl等,共5种,
故答案为:5.
点评 本题考查了有机物的推断,为高频考点,根据有机物的结构、官能团及其性质结合反应条件来分析解答,答题时注意官能团的相互转化,易错点为(3),注意同分异构体的判断,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 溶液中加入HNO3无现象,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中有SO42- |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | 向溶液中加入少量KSCN溶液 | 有血红色溶液生成 | 溶液中含有Fe2+ |
| D | 向硫酸铜溶液中持续滴加氨水溶液 | 先有蓝色沉淀生成后溶解 | 氢氧化铜发生反应生成了[Cu(NH3)4]2+离子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
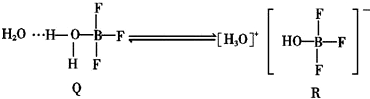
| A. | 离子键 | B. | 配位键 | C. | 非极性共价键 | D. | 氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据以下有关信息确定有机物的组成
根据以下有关信息确定有机物的组成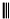 +
+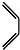 $\stackrel{△}{→}$
$\stackrel{△}{→}$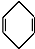 如果要合成
如果要合成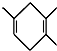 ,所用的起始原料的结构简式为C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3.
,所用的起始原料的结构简式为C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com