
| A. | 发生氧化反应的为负极 | B. | 正极为电子流入的一极 | ||
| C. | 活泼性较强的金属为负极 | D. | 电流表偏向的为正极 |
分析 原电池中,得电子发生还原反应的电极是正极,失电子发生氧化反应的电极是负极,电流从正极沿导线流向负极,电子与电流流向相反,电流表指针的偏向负极.
解答 解:A.失电子发生氧化反应的电极是负极,所以负极上发生氧化反应,故A正确;
B.负极上失电子,正极上得电子,所以外电路中电子从负极沿导线流向正极,则正极为电子流入的一极,故B正确;
C.原电池中两个电极为活泼性不同的金属时,活泼的金属作负极,故C正确;
D.电流表指针向电流流进去的方向偏,电流由正极流向负极,所以电流表偏向负极,故D错误;
故选D.
点评 本题考查了原电池正负极的判断,其判断方法有:电子的流向、电流的流向、电极上得失电子、电极上发生反应类型、电流表指针的偏向等,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 该分子中含有2种官能团 | |
| B. | 可与FeCl3溶液作用显紫色 | |
| C. | 1 mol莽草酸可与4 mol NaOH或2molBr2完全反应 | |
| D. | 在一定条件下,该物质既可发生加成反应也可发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O与18O互为同素异形体 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 标准状况下,11.2L16O2和11.2L18O2均含NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤 | 有难溶物存在 |
| 步骤2: | ①有无色气泡产生,说明有CaCO3 ②出现无色气泡,说明含有碳酸钙,说明有若有难溶物存在,说明有二氧化硅 |
| 步骤3: | |
| … |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 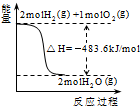 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 | |
| B. | 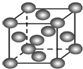 表示Cu形成金属晶体时的堆积方式 表示Cu形成金属晶体时的堆积方式 | |
| C. | 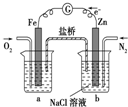 装置中烧杯a中的溶液pH降低 装置中烧杯a中的溶液pH降低 | |
| D. |  装置中待镀铁制品应与电源正极相连 装置中待镀铁制品应与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C为短周期元素,在周期表中所处的位置如右图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍.
A、B、C为短周期元素,在周期表中所处的位置如右图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 周期表中位置靠近的元素性质相似 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com