
| A. | CuCl2溶液与Fe的反应:Cu2++Fe═Fe3++Cu | |
| B. | 向硫酸氢钠溶液中加入少量氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 向碳酸钙固体中加入稀盐酸:CO32-+2 H+═CO2↑+H2O | |
| D. | 向碳酸钠溶液中加入澄清的石灰水:Ca2++CO32-═CaCO3↓ |
分析 A.反应生成氯化亚铁和Cu;
B.漏写生成水的离子反应;
C.碳酸钙在离子反应中保留化学式;
D.反应生成碳酸钙和NaOH.
解答 解:A.CuCl2溶液与Fe的反应的离子反应为Cu2++Fe═Fe2++Cu,故A错误;
B.向硫酸氢钠溶液中加入氢氧化钡溶液的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故B错误;
C.向碳酸钙固体中加入稀盐酸的离子反应为CaCO3+2 H+═Ca2++CO2↑+H2O,故C错误;
D.向碳酸钠溶液中加入澄清的石灰水的离子反应为Ca2++CO32-═CaCO3↓,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应方程式的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) $?_{500℉、30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| D. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应△H=+2×283.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱沾在皮肤上立即抹上稀硫酸 | |
| B. | “油锅”着火用锅盖或湿布盖灭 | |
| C. | 浓硫酸沾在皮肤上,先用干布或用纸吸干,再用大量清水冲洗 | |
| D. | 发生CO中毒时,首先采取开门、窗通风的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,1.01×105Pa,22.4LSO2中含有的原子数为3NA | |
| B. | 1 mol S2-中的电子数为18NA | |
| C. | 7.8gNa2O2加入足量的水中,转移的电子数为0.2NA | |
| D. | 在标准状况下,各为l mol的二氧化硫、CCl4的体积均约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄吃起来是酸的,故它属于酸性食物 | |
| B. | 正常人的人体内体液pH总保持恒定 | |
| C. | 食物的酸碱性与化学上所指溶液的酸碱性不同的 | |
| D. | 蛋白质在体内经消化后生成碳酸、硫酸、尿酸等,故它属于酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锌层破损后即对镀锌铁(白铁)制品失去保护作用 | |
| B. | 制备氢氧化铁胶体时,应向FeCl3溶液中滴加NaOH溶液,并继续煮沸至液体呈红褐色 | |
| C. | 用托盘天平称取5.85g NaCl,称量时砝码放在右盘,氯化钠放在左盘 | |
| D. | 用灼烧闻气味的方法可以区别棉花和羊毛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
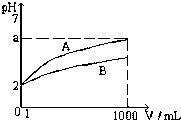 T℃时,pH=2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示
T℃时,pH=2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com