
| A、向1 mo1?L-l CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | ||||||||||
B、25℃时,将a mol?L-l氨水与0.01mol?L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示反应完全时NH3?H2O的电离常数Kb=
| ||||||||||
C、根据表中数据可以计算出 (g)+3H2(g)→ (g)+3H2(g)→ (g)的焓变 (g)的焓变
| ||||||||||
| D、已知298K时,MgCO3的Ksp=6.82×10-6,溶液中c(Mg2+)=0.0001mol?L-1,c(CO32-)=0.0001mol?L-1,此时Mg2+和CO32-不能共存 |
| c(NH4+).c(OH-) |
| c(NH3.H2O) |
| c(NH4+).c(OH-) |
| c(NH3.H2O) |
| 0.005×10-7 |
| 0.5×(a-0.01) |
| 10-9 |
| a-0.01 |


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
| A、在1L 0.1mol/L的醋酸溶液中所含分子数目小于0.1NA |
| B、质量相同的N2和CO中,含有的电子数均为14NA |
| C、标准状况下,11.2L氮气和22.4L氢气在一定条件下充分反应,原子数目小于3NA |
| D、在V L 0.1mol/L的氯化铁溶液中,若Fe3+的数目为NA,Cl-的数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性锌锰电池中,MnO2是催化剂 |
| B、银锌纽扣电池工作时,Ag2O被还原为Ag |
| C、放电时,铅酸蓄电池中硫酸浓度不断增大 |
| D、电镀时,待镀的金属制品表面发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol乙烯和乙醇的混合物完全燃烧所消耗的O2一定为0.3NA |
| B、常温常压下,46g NO2与N2O4的混合气体中含有的分子总数为NA |
| C、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
| D、一定量的钠与8g氧气作用,若两者均无剩余,转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,16g O3含有NA个O3 |
| B、1mol?L-1的Ca(ClO)2溶液中含ClO-数目为2NA |
| C、标准状况下,22.4L HCl溶于1L水中所得的盐酸含有NA个HCl分子 |
| D、1mol Mg在空气中完全燃烧生成MgO和Mg3N2,失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通过浓硫酸除去HCl中的H2O |
| B、通过灼热的CuO除去H2中的CO |
| C、通过灼热的镁粉除去N2中的O2 |
| D、通过水除去CO中的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol N2与足量的H2反应,转移的电子数是0.6NA |
| B、常温下,0.1mol?L-1 NH4NO3溶液中含有的氮原子数是0.2NA |
| C、常温常压下,3.2g O2和3.2g O3所含氧原子数都是0.2NA |
| D、2.24L CO和CO2的混合气体中所含的碳原子数为0.1N A |
查看答案和解析>>
科目:高中化学 来源: 题型:
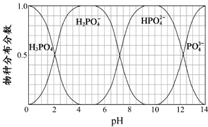 磷和砷是同主族的非金属元素.
磷和砷是同主族的非金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗中上层液体应从漏斗口倒出 |
| B、蒸馏时,温度计水银球靠近蒸馏烧瓶支管口 |
| C、滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、蒸发时,当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com