
| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 甲苯 |
分析 使溴的四氯化碳溶液溶液褪色,说明能够与溴发生加成反应,反应物分子中必须含有不饱和键,
使高锰酸钾溶液褪色,说明发生了氧化还原反应,烃类物质中,不饱和烃以及含有侧链的芳香烃可被氧化,以此解答.
解答 解:A.甲烷不含不饱和键,化学性质稳定,不能使溴的四氯化碳溶液和高锰酸钾酸性溶液褪色,故A错误;
B.乙烯含有碳碳双键,可与溴发生加成反应,可被酸性高锰酸钾氧化,故B正确;
C.苯性质稳定,与高锰酸钾不反应,不含有碳碳双键,与溴不反应,故C错误;
D.甲苯可被酸性高锰酸钾氧化,但与溴的四氯化碳溶液不反应,故D错误.
故选B.
点评 本题主要考查有机物的结构和性质,侧重于烯烃以及苯的同系物的考查,使溴的四氯化碳溶液溶液褪色,说明能够与溴发生加成反应,反应物分子中必须含有不饱和键,使高锰酸钾溶液褪色,说明发生了氧化还原反应,本题难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在三种元素中,元素Z的非金属性最强 | |
| B. | 气态氢化物的还原性按X、Y、Z的顺序逐渐增强 | |
| C. | Y元素一定是硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
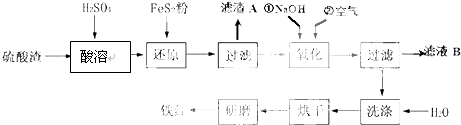
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )| A. | 铜电极附近观察到黄绿色气体 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 铜电极上发生还原反应 | D. | 溶液中的Na+向石墨电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.3 |
| 密度/g•cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 难溶 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com