
分析 C燃烧生成二氧化碳,CnH2n+2和CH4燃烧生成二氧化碳和水,质量相同时,生成二氧化碳越少,则对环境造成的负面影响越小,可根据含氢量判断,以此解答该题.
解答 解:C燃烧生成二氧化碳,反应的化学方程式为C+O2=CO2,CnH2n+2和CH4燃烧生成二氧化碳和水,燃烧的化学方程式为CnH2n+2+(n+$\frac{2n+2}{4}$)O2=CO2+(n+1)H2O,CH4+2O2=CO2+2H2O,质量相同时,生成二氧化碳越少,则对环境造成的负面影响越小,CH4的含氢量最大,则生成二氧化碳最少,对环境污染最小,
答:它们燃烧过程的化学方程式分别为C+O2=CO2、CnH2n+2+(n+$\frac{2n+2}{4}$)O2=CO2+(n+1)H2O、CH4+2O2=CO2+2H2O,CH4对环境造成的负面影响(温室效应)最小.
点评 本题考查环境问题,为高频考点,侧重于化学与生后、生产的考查,有利于培养学生良好的科学素养,树立环保意识,难度不大,注意相关基础的积累.


科目:高中化学 来源: 题型:实验题
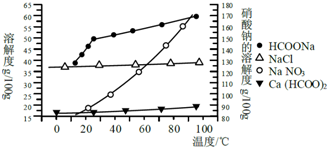
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98g | |
| B. | 1mol O2的体积是22.4L | |
| C. | 18g H2O含有的原子总数为3NA | |
| D. | 0.1 mol•L-1 BaCl2溶液中,Cl-的物质的量浓度为0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹是有色固体 | B. | 砹易溶于有机溶剂 | ||
| C. | 砹化氢很稳定 | D. | 砹化银不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 标况下气体的摩尔体积约为22.4升 | |
| C. | 1L0.5mol/LFeCl3的溶液与0.2L1mol/LKCl溶液中Cl-数目之比为15:2 | |
| D. | 100mL1mol/LNaCl溶液与50mL1mol/LAlCl3溶液中Cl-物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
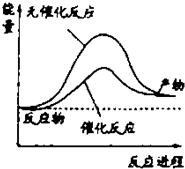
| A. | 如图可表示水分解过程中的能量变化 | |
| B. | 若2C(s)+O2(g)=2CO(g)△=-221.0kJ/mol,则碳的燃烧热为110.5kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知I:反应H2(g)+Cl2(g)=2HCl(g)△=-akJ/mol II:  且a、b、c均大于零,则断开1mol H-Cl键所需的能量为(-a-b-c)kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com