
| 137 |
| 233 |
| 112 |
| 160 |
| 2.56 |
| 12.52 |
| 2.74 |
| 137 |
| 2.24 |
| 56 |
| 2.56 |
| 16 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、2mol、3mol |
| B、2mol、1mol |
| C、1.5mol、1.5mol |
| D、2.5mol、1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是化学上常用的一个物理量 |
| B、某物质含有6.02×1023个微粒,含有这个数目微粒的物质一定是1mol |
| C、1摩尔氢气分子可以表示为1molH2 |
| D、硫酸的摩尔质量为98g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.2 |
| Zn2+ | 6.2 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 往AlCl3溶液中逐滴加入NaOH溶液至过量 |
B、 往澄清石灰水中缓慢通入CO2气体至过量 |
C、 往含MgCl2、AlCl3各1mol的混合溶液中逐滴加入NaOH溶液至过量 |
D、 往NaOH和NaAlO2混合溶液中逐滴加入盐酸至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
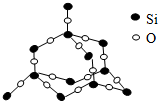 二氧化硅晶体是立体的网状结构.其晶体模型如图所示.认真观察晶体模型并回答下列问题:
二氧化硅晶体是立体的网状结构.其晶体模型如图所示.认真观察晶体模型并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+ K+ Cl- NO3- |
| B、K+ Al3+ Cl- CO32- |
| C、K+ Na+ CO32- NO3- |
| D、Al3+ Cu2+ SO42- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
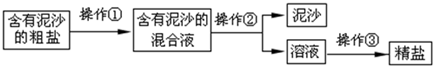
查看答案和解析>>
科目:高中化学 来源: 题型:
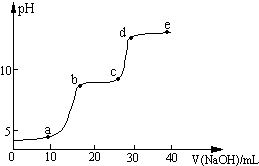 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol?L-1 MgSO4、0.05mol?L-1 Al2(SO4)3的混合溶液中滴加0.5mol?L-1 NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol?L-1 MgSO4、0.05mol?L-1 Al2(SO4)3的混合溶液中滴加0.5mol?L-1 NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com