
【题目】某有机物和足量的银氨溶液在微热条件下发生银镜反应,生成10.8 g银,而燃烧等量的有机物时,需消耗氧气6.16 L(标准状况),该有机物是( )
A. 葡萄糖 B. 甲酸乙酯 C. 丁醛 D. 乙醛
【答案】C
【解析】
根据题意,该有机物与足量的银氨溶液在微热条件下发生银镜反应,生成10.8g银,即0.1mol银。根据银镜反应可知,1mol醛基被氧化,可以生成2mol单质银,则生成0.1mol银,需要的醛基为0.05mol,等量的该有机物燃烧时消耗标准状况下氧气6.16 L,氧气的物质的量是0.275mol,根据这两个结果结合各选项进行讨论即可。
10.8g银的物质的量为10.8g÷108g/mol=0.1mol,由银镜反应的关系式:-CHO~2Ag可知,醛基的物质的量为:0.05mol,标准状况下6.16L氧气的物质的量为:6.16L÷22.4L/mol=0.275mol,若为一元醛,则1mol该醛完全燃烧消耗氧气的物质的量为:0.275mol×![]() =5.5mol,若为甲醛或二元醛,则1mol醛完全燃烧消耗的氧气的物质的量为:
=5.5mol,若为甲醛或二元醛,则1mol醛完全燃烧消耗的氧气的物质的量为:![]() =11mol。
=11mol。
A.葡萄糖燃烧的关系式为:C6H12O6~6O2,1mol葡萄糖完全燃烧消耗6mol氧气,故A错误;
B.甲酸乙酯燃烧的关系式为:C3H6O2~3.5O2,1mol甲酸乙酯完全燃烧消耗3.5mol氧气,故B错误;
C.丁醛燃烧的关系式为:C4H8O~5.5O2,符合题意,故C正确;
D.乙醛燃烧的关系式为:C2H4O~2.5O2,1mol乙醛完全燃烧消耗2.5mol氧气,故D错误,答案选C。


科目:高中化学 来源: 题型:
【题目】请用下列仪器和药品组成一套由含有硫化钙杂质的电石进行乙炔气体的制备、净化、检验,并可通过计算确定乙炔产率的系列实验装置,溴水的浓度为0.1 mol/L,体积是20mL,NaOH溶液足量。
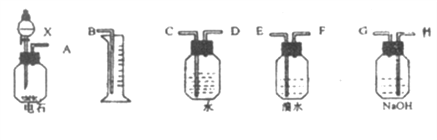
(1)如果所制气体从左到右流向时,进行实验时仪器的正确连接顺序是(填A、B、…) ____ 接 ; 接 ; 接 ; 接 。
(2)为了使实验中气流平稳,液体X通常用_________________________。
(3)实验中盛溴水的瓶中可观察到的现象是_________________________。
(4)假定溴水与乙炔完全反应,生成C2H2Br4,用含amol碳化钙的电石Wg与足量X反应,反应完全后,量筒内排入了VL液体(在标准状况下测定),则乙炔的产率为_____________________(只需列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把200mL NH4HCO3和Na2CO3 的混合溶液分成两等份,取一份加入含amol NaOH的溶液恰好反应完全;取另一份加入含bmol HCl的盐酸恰好反应完全。该混合溶液中c(Na+)为
A. (l0b - 5a))mol/LB. (2b-a)mol/L
C. (![]() )mol/LD. (5b-
)mol/LD. (5b-![]() )mol/L
)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将充有m mLNO 和n mLNO2的量筒倒立于水槽中,然后通入m mL O2,若m<n,则充分反应后量筒内气体体积(mL)为( )
A. 3(m-n)B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。

(1)实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中______装置(填装置序号)制Cl2,在制Cl2的反应中浓盐酸所表现出的性质是______.
(2)应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:________, D:_________.
(3)装置C的作用是__________。
(4)甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性,试分析:
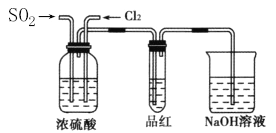
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是____________。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色。其原因是 ,并写出其相应的离子方程式:_________.
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅。其原因________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜铁合金中铜和铁的物质的量之和为ymol,其中铜的物质的量分数为a,将其全部投入50mLbmol/L的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
A. 当溶液中金属离子只有铁离子和铜离子时,则a和b的关系为b≥80y(1-a/3)
B. 若金属有剩余,在溶液中再滴入硫酸后,金属不会溶解
C. 若金属全部溶解,则溶液中一定含有铁离子
D. 若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组的性质比较正确的是( )
A. 稳定性:NH3<PH3 < SiH4 B. 酸性:HClO4 >H2SO4 > H3PO4
C. 碱性:KOH < NaOH < Mg(OH)2 D. 还原性:F— > Cl— > Br—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四物质有如下转化关系(反应条件和部分产物已略去):A![]() B
B![]() C
C![]() D,回答下列问题:
D,回答下列问题:
(1)若A为气态氢化物和D能通过化合反应生成一种盐,则
①写出实验室制取A的化学方程式:______________________________________;
②写出由A生成B的化学方程式:______________________________________;
③某同学用干燥的圆底烧瓶收集一瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉。用方程式解释喷泉呈红色的原因:_____________________________________________。
(2)若A与B反应能生成一种淡黄色固体单质,写出该反应的化学方程式:_______________________。
(3)若A是金属单质,C是一种淡黄色固体,写出C生成D的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)由1H216O与2H217O所代表的物质中,共有__________种元素,_________种原子,16O、17O的关系为________。
(2)红热木炭放入浓硫酸产生气体过程的化学反应方程式______________________。
(3)硫酸型酸雨产生的原因________________________________(化学方程式)
(4)SO2通入酸性高锰酸钾溶液中的离子方程式____________________________
(5)现有2.96 g铁的硫化物在空气中完全反应,生成2.40 g红色粉末(Fe2O3),并放出有刺激性气味的气体。将该气体通入溴水中,溶液褪色。用离子方程式表示溴水褪色的原因:___________________;通过计算,该铁的硫化物化学式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com