
【题目】下列反应既属于氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2的反应
B. Na2O2与H2O的反应
C. 镁条与稀盐酸的反应
D. 碳酸钙高温分解的反应
科目:高中化学 来源: 题型:
【题目】某实验小组研究溶液中AgNO3和Na2S的反应。
实验 | 试剂 | 现象 | |
| 试管 | 滴管 | |
(pH = 4) |
(pH = 9) | 出现黑色沉淀 | |
(1)用离子方程式解释Na2S溶液pH > 7的原因:________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为![]() 和
和![]() ;
;
ii.Ag2O能溶解在浓氨水中形成银氨溶液,而Ag2S和Ag均不能。
① 设计并实施如下实验,证实沉淀中含有Ag2S。

试剂1和试剂2分别是_________、_________。
现象1和现象2分别是_________、_________。
② 设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作和现象补充完整。
实验操作 | 实验现象 | |
步骤i | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀,____________ | ____________ |
③ 经检验,沉淀不含有Ag。

(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如右图所示),测得电压为a(![]() )。
)。
对AgNO3溶液中氧化![]() 的物质进行推测:
的物质进行推测:
假设1: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() ;
;
假设2: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() 。
。
利用右图装置继续研究(已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
① 将![]() 的AgNO3溶液替换为_______溶液,记录电压为b(
的AgNO3溶液替换为_______溶液,记录电压为b(![]() )。
)。
② 上述实验证实了氧化![]() 的物质中一定包含
的物质中一定包含![]() ,其证据是______。
,其证据是______。
实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_____________________。
(2)工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为2:1。
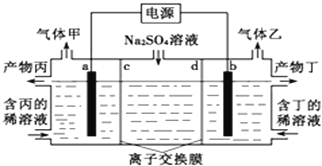
①气体甲的化学式____________ 。
②a极与电源的____________ (填“正极”或“负极”)相连,该电极反应式为_______________。
③离子交换膜d为________(填“阴离子”或“阳离子”)交换膜。
④产物丙为_________ 溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:C(s)+CO2(g)=2CO(g),下列说法不正确的是( )
A. 将碳块磨成粉末可以加快反应速率
B. 升高温度可以加快反应速率
C. 增加碳的质量可以加快反应速率
D. 容器体积不变时,向其中充入N2,反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语中,正确的是
A. 氯化氢分子的形成过程可用电子式表示为:![]()
B. 16O与 18O的中子数和核外电子排布均不同
C. 稳定性:CH4>SiH4;还原性:HCl>H2S
D. K+、Ca2+、Mg2+的离子半径依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NH4HCO3![]() NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
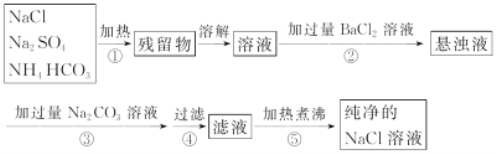
(1)操作④中所需的玻璃仪器有__________________。
(2)操作②为什么不用硝酸钡溶液,其理由是__________。
(3)进行操作②后,如何判断SO42-已除尽,方法是______
(4)操作③的目的是__________,其相应的化学方程式为:_____;为什么不先过滤,后加碳酸钠溶液,其理由是_______。
(5)说明此设计方案不严密之处及正确的方法____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 向明矾溶液中加入足量的烧碱溶液: Al3+ + 3OH-= Al(OH)3↓
B. 在含有等物质的量的Fe(NO3) 2和KI组成的混合溶液中滴入稀盐酸:3Fe2+ + 4H+ + NO3-=3Fe3+ + NO↑ + 2H2O
C. 碳酸氢铵溶液中滴加足量的NaOH溶液:HCO3-+ OH-= CO32- + H2O
D. 纯碱溶液呈碱性的原因:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量NO2气体,且起始时体积相同。发生反应:2NO2(g)![]() N2O4(g) △H<0。一段时间后均达到平衡状态。下列说法中正确的是
N2O4(g) △H<0。一段时间后均达到平衡状态。下列说法中正确的是
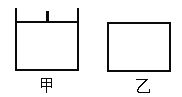
A. 平衡时NO2体积分数:甲<乙
B. 达到平衡所需时间,甲与乙相等
C. 该反应的平衡常数表达式K=c(N2O4)/c(NO2)
D. 若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛.以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:(已知Ksp=3.810﹣38; Ksp=210﹣20;Ksp(ZnS)=1.610﹣24)
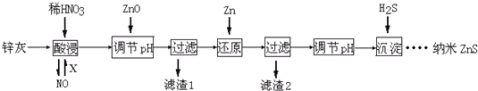
下列说法不正确的是:
A. 酸浸时FeO与稀HNO3反应的离子方程式为3FeO+10H++ NO3﹣═3Fe3++NO↑+5H2O
B. 将酸浸的尾气循环利用,加入的X气体可以是O2
C. 滤渣2中的成分是Zn和Fe
D. 当溶液中Zn2+浓度为小于1.010﹣5molL﹣1时,则可认为其沉淀完全.若要使Zn2+沉淀完全,溶液中S2﹣浓度应大于1.610﹣19molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com