
【题目】向一体积不变的密闭容器中充入![]() 和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中
和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中![]() 阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且
阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且![]() 各改变一种不同的条件。
各改变一种不同的条件。
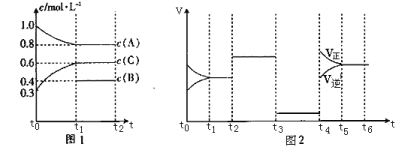
(1)![]() 时改变的条件为___________,B的起始物质的量为____________。
时改变的条件为___________,B的起始物质的量为____________。
(2)各阶段平衡时对应的平衡常数如下表所示:
|
|
|
|
|
|
|
|
则![]() 之间的关系为___________。(用“>”、“<”或“=”)。
之间的关系为___________。(用“>”、“<”或“=”)。
(3)![]() 阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________。
阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________。
【答案】减小压强(或抽取出部分平衡混合气) ![]() K1=K2=K3<K4 2A(g)+B(g)3C(g)
K1=K2=K3<K4 2A(g)+B(g)3C(g) ![]()
【解析】
(1)t2-t3和t3-t4这两段平衡时不移动的,则只能是压强和催化剂影响的,因此应该推断该反应为等体积变化的反应,t2-t3的平衡比原平衡的速率要快,而t3-t4的速率又变慢,则前者应加入催化剂,因为条件只能使用一次,t3-t4段应为减压或取出部分平衡混合气体;反应物的浓度降低,生成物的浓度增大,结合图1可以知道,A为反应物,C为生成物,A的变化量为0.2mol/L,C的变化量为0.3mol/L。又因该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率比等于化学计量数比,该反应的方程式为2A(g)+B(g)![]() 3C(g),所以c(B)=
3C(g),所以c(B)=![]() c(A)=
c(A)=![]() mol/L=0.1mol/L,起始2molA所以对应浓度为1mol/L,则体积应为2L,故B的起始物质的量为n(B)=(0.1mol/L+0.4mol/L)
mol/L=0.1mol/L,起始2molA所以对应浓度为1mol/L,则体积应为2L,故B的起始物质的量为n(B)=(0.1mol/L+0.4mol/L)![]() 2L=1.0mol;
2L=1.0mol;
(2)t1-t2段,处于平衡状态,c(A)=0.8mol/L,c(B)=0.4mol/L,c(C)=0.6mol/L,K1=![]() =
=![]() =0.84;t2-t3段为使用催化剂,加快反应,平衡常数不变,K2=0.84;t3-t4段为降低压强,反应速率降低,平衡不移动,平衡常数不变,K3=0.84;t5-t6段,为升高温度,平衡向正反应方向移动,平衡常数增大,K4>0.84,故K1=K2=K3<K4;
=0.84;t2-t3段为使用催化剂,加快反应,平衡常数不变,K2=0.84;t3-t4段为降低压强,反应速率降低,平衡不移动,平衡常数不变,K3=0.84;t5-t6段,为升高温度,平衡向正反应方向移动,平衡常数增大,K4>0.84,故K1=K2=K3<K4;
(3)根据方程式计算,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,则反应2molA时,交换热量为200a kJ,而由图象可以知道,t4-t5阶段应为升高温度,正反应速率大于逆反应速率,平衡向正反应方向移动,则正反应应为吸热反应,所以热化学方程式为2A(g)+B(g)![]() 3C(g) H=+200a kJ/mol。
3C(g) H=+200a kJ/mol。


科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。已知 1 molSO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1 。
2SO3(g)反应过程的能量变化如图所示。已知 1 molSO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1 。

请回答下列问题:
(1)图中A、C分别表示____________________、___________________,E的大小对该反应的反应热有无影响?________________。该反应通常用 V2O5 作催化剂,加V2O5会使图中B点升高还是降低?__________, 理由是______________________;
(2)图中ΔH=_____kJ·mol-1;
(3) V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式_____;
(4)已知单质硫的标准燃烧热 ΔH=﹣296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)放出的热量 为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用下面示意图表示的是
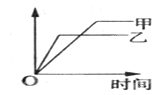
反应 | 纵坐标 | 甲 | 乙 | |
A | SO2与O2在同温、同体积容器中反应 | SO2的转化率 | 2molSO2和1molO2 | 2molSO2和2molO2 |
B | 2molSO2与1molO2在同温、体积可变的恒压容器中反应 | SO2的转化率 | 1×106Pa | 1×105Pa |
C | 相同质量氨,在同一固定容积容器中反应 | 氨气的浓度 | 400℃ | 500℃ |
D | 体积比为1:3的N2、H2在同温、体积可变的恒压容器中反应 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO常用于工业冶炼金属。在不同温度下CO还原四种金属氧化物达平衡后气体中![]() 与温度
与温度![]() 的关系曲线如图。下列说法正确的是
的关系曲线如图。下列说法正确的是

A.通过增高反应炉的高度,增大矿石和CO接触面积,能减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属Cr
C.CO还原![]() 的反应
的反应![]()
D.工业冶炼金属Cu时,高温有利于提高CO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1,则a>b
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH= -57.3 kJ·mol-1,则含1mol NaOH的稀溶液与足量稀醋酸完全中和,放出的热量等于57.3kJ
C.已知P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定
D.已知H2(g)+I2(g)![]() 2HI(g) ΔH= -a kJ·mol-1向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ
2HI(g) ΔH= -a kJ·mol-1向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,各物质之间的转化关系如图所示![]() 部分反应条件略去
部分反应条件略去![]() .
.
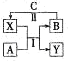
![]() 若X是光导纤维的主要成分,工业上常利用反应Ⅰ制备B,Y的化学式为 ____,B的其中一种用途为 ______ .
若X是光导纤维的主要成分,工业上常利用反应Ⅰ制备B,Y的化学式为 ____,B的其中一种用途为 ______ .
![]() 若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为 ______ .
若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为 ______ .
![]() 若组成A的元素在短周期中原子半径最大
若组成A的元素在短周期中原子半径最大![]() 稀有气体除外
稀有气体除外![]() ,以Y为电解质溶液,气体B为燃料,C为氧化剂可构成碱性燃料电池,其负极反应式为 ______ ,工作一段时间后,Y溶液的pH ______
,以Y为电解质溶液,气体B为燃料,C为氧化剂可构成碱性燃料电池,其负极反应式为 ______ ,工作一段时间后,Y溶液的pH ______ ![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() .
.
![]() 若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应Ⅰ检验氯气管道是否漏气.
若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应Ⅰ检验氯气管道是否漏气.
![]() 的电子式为 ______ ,反应Ⅰ的化学方程式为 ______ .
的电子式为 ______ ,反应Ⅰ的化学方程式为 ______ .
![]() 将
将![]() 的X溶液与
的X溶液与![]() 的Y溶液等体积混合,所得溶液中各离子浓度由大到小的顺序为 ______ .
的Y溶液等体积混合,所得溶液中各离子浓度由大到小的顺序为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )

A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.金属镁和卤素单质(X2)的反应都是放热反应
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换反应是重要的化工过程,反应方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH。我国科学家在这一变换中利用双功能催化剂突破了低温下高转化率与高反应速率不能兼得的难题。反应历程如图所示:
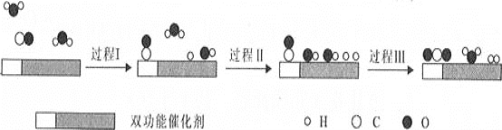
下列说法错误的是( )
A.该反应ΔH<0
B.根据历程图示过程Ⅰ为吸热过程、过程Ⅲ为放热过程
C.整个历程中两个H2O分子都参与了反应
D.使用双功能催化剂降低了水煤气变换反应的ΔH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的化学方程式或离子方程式正确的是
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
B.实验室用液溴和苯在催化剂作用下制溴苯:![]() + Br2
+ Br2![]()
![]() +HBr
+HBr
C.实验室用乙醇制乙烯:CH3CH2OH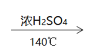 CH2=CH2↑+H2O
CH2=CH2↑+H2O
D.少量苯酚与浓溴水的反应:![]() +3Br2
+3Br2![]()
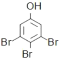 ↓+3HBr
↓+3HBr
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com