
恒温、恒压下,在一个容积可变的容器中发生如下反应:
N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
(1)若开始时放入1mol N2和3 molH2,达到平衡后,生成a mol NH3,这时N2的物质的量为 mol;
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入N2和H2的物质的量分别为 mol和 mol;
(3)若开始时放入x mol N2、6 molH2和2 molNH3,达到平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x= ,y= ,平衡时H2的物质的量_____(选填一个编号)。
A.大于6 mol B.等于6 mol C.小于6 mol D.可能大于、小于或等于6 mol
作出判断的理由是 ;
(4)若在(3)的平衡混合物中,再加入6 molNH3,再次达到平衡后,NH3的质量分数为 。
科目:高中化学 来源: 题型:
向100 mL NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入二氧化碳的体积V(标准状况下)与M的质量W的关系如图所示。请回答下列问题:
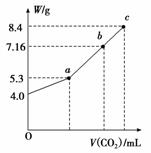
(1)b点时M的组成成分为____________________。
(2)若要使b点生成的盐的质量变为8.4 g,则应继续向溶液中通入二氧化碳________L(标准状况下)。
(3)若向生成的7.16 g盐的溶液中加入一定量的某物质,充分反应后,减压低温蒸发得到纯净的碳酸钠固体(无结晶水)8.4 g。
①若只加入0.03 mol某物质,则加入的物质可以是________或________。
②若只加入0.06 mol某物质,则加入的物质可以是________、________或________。
(4)常温下,同浓度的碳酸钠溶液和碳酸氢钠溶液的pH都大于7,二者中________的pH更大,理由是__________
________________________________________________________________________;
0.1 mol·L-1碳酸钠溶液中离子浓度的大小关系是
________________________________________________________________________;
向碳酸氢钠溶液中逐滴滴入氢氧化钡溶液,发生反应的离子方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,向容积固定的密闭容器里充入a mol N2O4发生如下反应:N2O4 (气) 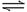 2NO2 (气),达到平衡后,再向该容器内充入a mol N2O4,达平衡后与原平衡比较正确的是 ( )
2NO2 (气),达到平衡后,再向该容器内充入a mol N2O4,达平衡后与原平衡比较正确的是 ( )
A.平均相对分子质量减小 B.N2O4的转化率提高
C.压强为原来的2倍 D.颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b

查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应 A(气) + nB(气)  2C(气) (正反应吸热)在一定温度下,反应物 B 的转化率与压强有如图所示的关系,那么 n 值一定是( )
2C(气) (正反应吸热)在一定温度下,反应物 B 的转化率与压强有如图所示的关系,那么 n 值一定是( )
A.>1 B.≥ 1 C.1 D. 2
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
A.原子半径的大小顺序为W>Q>Z>X>Y
B.元素X的气态氢化物与Q的单质可发生置换反应
C.元素X与Y可以形成5种以上的化合物
D.元素Q的最高价氧化物对应的水化物酸性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示:
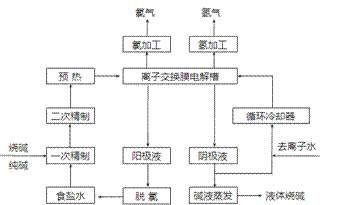
(1)该流程中可以循环的物质是 。
 (2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式 ,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式 ,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果 。
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是 ,E电极的名称是 。电解总反应的离子方程式为 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
密闭容器中进行下列反应:M(g)+N(g) 
 R(g)+2 L,如图所示R%是
R(g)+2 L,如图所示R%是
 R的体积分数,t是时间,下列关
R的体积分数,t是时间,下列关
于该反应的分析正确的是( )
A.正反应吸热,L为气体
B.正反应吸热,L为固体或纯液体
C.正反应放热,L为气体
D.正反应放热,L为固体或纯液体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述正确的是( )
|
| A. | 已知2H2 (g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
|
| B. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol |
|
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
|
| D. | 已知C (s)+O2(g)═CO2(g)△H1;C(s)+1/2 O2(g)═CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com